本试题 “I.实验室用Na2CO3•10H2O晶体配制50g 质量分数为21.2%的Na2CO3溶液.回答下列问题:(1)应用托盘天平称取Na2CO3•10H2O晶体______ g.(2)用托盘天平和小烧...” 主要考查您对配制一定物质的量浓度的溶液
溶液质量分数的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 配制一定物质的量浓度的溶液
- 溶液质量分数的计算
配置一定物质的量浓度的溶液:
(1)仪器:容量瓶(应注明体积),烧杯,量筒,天平,玻璃棒,滴管
(2)原理:c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液)
(3)步骤:
第一步:计算。
第二步:称量:在天平上称量溶质,并将它倒入小烧杯中。
第三步:溶解:在盛有溶质的小烧杯中加入适量蒸馏水,用玻璃棒搅拌,使其溶解。
第四步:移液:将溶液沿玻璃棒注入容量瓶中。
第五步:洗涤:用蒸馏水洗烧杯2~3次,并倒入容量瓶中。
第六步:定容:倒水至刻度线1~2cm处改用胶头滴管滴到与凹液面平直。
第七步:摇匀:盖好瓶塞,上下颠倒、摇匀。
第八步:装瓶、贴签。
(4)误差分析:
①计算是否准确
若计算的溶质质量(或体积)偏大,则所配制的溶液浓度也偏大;反之浓度偏小。
如配制一定浓度的CuSO4溶液,把硫酸铜的质量误认为硫酸铜晶体的质量,导致计算值偏小,造成所配溶液浓度偏小。
②称、量是否无误
如称量NaOH固体在纸上或称量时间过长,会导致NaOH部分潮解甚至变质,有少量NaOH黏附在纸上,造成所配溶液浓度偏低。
量取液体溶质时,俯视或仰视量筒读数,会导致所取溶质的量偏少或偏多,造成所配溶液浓度偏小或偏大。
使用量筒量取液体溶质后再用蒸馏水冲洗量筒,把洗涤液也转入烧杯稀释,或用移液管将液体溶质移入烧杯中后把尖嘴处的残留液也吹入烧杯中。在制造量筒、移液管及滴定管时,已经把仪器内壁或尖嘴处的残留量扣除,所以上述操作均使溶质偏多,造成所配溶液浓度偏大。
③称量时天平未调零
结果不能确定。若此时天平重心偏左,则出称量值偏小,所配溶液的浓度也偏小;若重心偏小,则结果恰好相反。
④称量时托盘天平的砝码生锈
砝码由于生锈而使质量变大,导致称量值偏大,所配溶液的浓度偏高。
⑤操作中溶质有无损失
在溶液配制过程中,若溶质有损失,会使所配溶液浓度偏低。如:⑴溶解(或稀释)溶质,搅拌时有少量液体溅出;⑵未洗涤烧杯或玻璃棒;⑶洗涤液未转入容量瓶;⑷转移洗涤液时有少量液体溅出容量瓶。
影响溶液体积V的操作有:
①定容时不慎加水超过容量瓶的刻度线,再用胶头滴管吸出,使液面重新达到刻度线。当液面超过刻度线时,V偏大使溶液浓度CB已变小,无论是否取出都无法使溶液恢复,只有重新配制。
②定容后盖上瓶塞,摇匀后发现液面低于刻度线,再滴加蒸馏水使液面重新达到刻度线。定容时由于少量溶液粘在瓶颈处没有回流,使液面偏低但溶液浓度未变,若再加水,则使V偏大,cB偏小。
③定容时仰视或俯视
定容时仰视,则液面高于刻度线,V偏大,cB偏小;俯视时液面低于刻度线,V偏小,cB偏大。
④移液或定容时玻璃棒下端放在容量瓶刻度线之上
会导致V偏大,cB偏小。
⑤溶液未冷却至室温即转移入容量瓶
溶解或稀释过程常伴有热效应而使溶液温度升高或降低。容量瓶的使用温度为室温(20℃),若定容时溶液温度高于室温,会使所配溶液浓度偏高;反之浓度偏低。
(1)仪器:容量瓶(应注明体积),烧杯,量筒,天平,玻璃棒,滴管
(2)原理:c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液)
(3)步骤:
第一步:计算。
第二步:称量:在天平上称量溶质,并将它倒入小烧杯中。
第三步:溶解:在盛有溶质的小烧杯中加入适量蒸馏水,用玻璃棒搅拌,使其溶解。
第四步:移液:将溶液沿玻璃棒注入容量瓶中。
第五步:洗涤:用蒸馏水洗烧杯2~3次,并倒入容量瓶中。
第六步:定容:倒水至刻度线1~2cm处改用胶头滴管滴到与凹液面平直。
第七步:摇匀:盖好瓶塞,上下颠倒、摇匀。
第八步:装瓶、贴签。
(4)误差分析:
①计算是否准确
若计算的溶质质量(或体积)偏大,则所配制的溶液浓度也偏大;反之浓度偏小。
如配制一定浓度的CuSO4溶液,把硫酸铜的质量误认为硫酸铜晶体的质量,导致计算值偏小,造成所配溶液浓度偏小。
②称、量是否无误
如称量NaOH固体在纸上或称量时间过长,会导致NaOH部分潮解甚至变质,有少量NaOH黏附在纸上,造成所配溶液浓度偏低。
量取液体溶质时,俯视或仰视量筒读数,会导致所取溶质的量偏少或偏多,造成所配溶液浓度偏小或偏大。
使用量筒量取液体溶质后再用蒸馏水冲洗量筒,把洗涤液也转入烧杯稀释,或用移液管将液体溶质移入烧杯中后把尖嘴处的残留液也吹入烧杯中。在制造量筒、移液管及滴定管时,已经把仪器内壁或尖嘴处的残留量扣除,所以上述操作均使溶质偏多,造成所配溶液浓度偏大。
③称量时天平未调零
结果不能确定。若此时天平重心偏左,则出称量值偏小,所配溶液的浓度也偏小;若重心偏小,则结果恰好相反。
④称量时托盘天平的砝码生锈
砝码由于生锈而使质量变大,导致称量值偏大,所配溶液的浓度偏高。
⑤操作中溶质有无损失
在溶液配制过程中,若溶质有损失,会使所配溶液浓度偏低。如:⑴溶解(或稀释)溶质,搅拌时有少量液体溅出;⑵未洗涤烧杯或玻璃棒;⑶洗涤液未转入容量瓶;⑷转移洗涤液时有少量液体溅出容量瓶。
影响溶液体积V的操作有:
①定容时不慎加水超过容量瓶的刻度线,再用胶头滴管吸出,使液面重新达到刻度线。当液面超过刻度线时,V偏大使溶液浓度CB已变小,无论是否取出都无法使溶液恢复,只有重新配制。
②定容后盖上瓶塞,摇匀后发现液面低于刻度线,再滴加蒸馏水使液面重新达到刻度线。定容时由于少量溶液粘在瓶颈处没有回流,使液面偏低但溶液浓度未变,若再加水,则使V偏大,cB偏小。
③定容时仰视或俯视
定容时仰视,则液面高于刻度线,V偏大,cB偏小;俯视时液面低于刻度线,V偏小,cB偏大。
④移液或定容时玻璃棒下端放在容量瓶刻度线之上
会导致V偏大,cB偏小。
⑤溶液未冷却至室温即转移入容量瓶
溶解或稀释过程常伴有热效应而使溶液温度升高或降低。容量瓶的使用温度为室温(20℃),若定容时溶液温度高于室温,会使所配溶液浓度偏高;反之浓度偏低。
溶液质量分数的计算:
(1)溶质的质量分数=
(2)溶质的质量分数、溶质的物质的量浓度及溶液密度之间的关系:
①溶质的质量分数=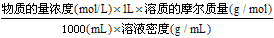
②物质的量浓度=
(1)溶质的质量分数=

(2)溶质的质量分数、溶质的物质的量浓度及溶液密度之间的关系:
①溶质的质量分数=
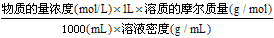
②物质的量浓度=

有关溶液密度的问题:
1.溶液质量分数与密度的关系
(1)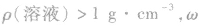 越大,则ρ(溶液)越大,常见溶液如NaCl溶液、硫酸溶液等。
越大,则ρ(溶液)越大,常见溶液如NaCl溶液、硫酸溶液等。
(2)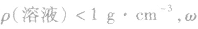 越大,则ρ(溶液)越小,常见溶液如氨水、酒精溶液等。
越大,则ρ(溶液)越小,常见溶液如氨水、酒精溶液等。
2.溶液混合后质量分数的变化规律
质量分数分别为 的两溶液(同种溶质)混合,混合后溶液的质量分数为ω。
的两溶液(同种溶质)混合,混合后溶液的质量分数为ω。
(1)等体积混合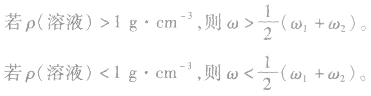
若是加等体积水稀释,可视 中其一为0 分析。
中其一为0 分析。
(2)等质量混合: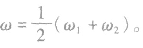
发现相似题
与“I.实验室用Na2CO3•10H2O晶体配制50g 质量分数为21.2%的Na2CO...”考查相似的试题有:
- 配制250ml 0.10mol/L的NaOH溶液时,下列实验操作会使得配制的溶液浓度偏大的是( )A.转移溶液后,未洗涤烧杯和玻璃棒就直接...
- 下列有关说法正确的是( )A.制取蒸馏水是把杂质从水中蒸出B.通过加热除去氯化铵固体中的碘单质C.在做钠与水反应的实验时...
- 阅读下列文字,填写文中带圈的数字后面的空白:某同学发现,纯度、质量、表面积都相同的两铝片与c(H+)浓度相同的盐酸和硫酸在...
- 实验室需配制一种符合下列条件的溶液:①无色且仅含四种溶质离子②四种离子的物质的量浓度均为1mol/L.则符合该条件的是( )A...
- 2011年8月12日,网传云南曲靖市越州镇约5000余吨的重毒化工废料铬渣非法丢放,毒水被直接排放南盘江中。Ⅰ:某工厂对制革工业...
- 下图为病人输液用的葡萄糖(化学式为C6H12O6)注射液标签上的部分內容。(该注射液就是葡萄糖的水溶液)试根据标签上的有关数...
- 下列实验操作正确的是[ ]A.加入盐酸以除去硫酸钠中的少量碳酸钠杂质B.配制溶液定容时,用胶头滴管滴加蒸馏水至溶液凹液面最...
- 实验室配制480mL 0.5mol•L-1的NaOH溶液时,下列操作会使结果偏低的是( )A.溶解后没有冷却就转移到容量瓶中B.洗涤容量瓶后...
- 实验室需要配制100mL 1mol/L的NaOH溶液,进行了如下操作:①把称量好的固体NaOH放入小烧杯中,加适量蒸馏水溶解.为加速溶解,...
- 将37.2gNa、Na2O、Na2O2组成的混合物放入盛有206.4mL水(密度为1.0g/cm3)的特定容器中充分反应,将反应后产生的气体全部收集...