本试题 “下列有关溶液的叙述正确的是[ ]A.常温下的醋酸铵溶液中c(H+)>c(OH-)B.在pH=2的醋酸中加入等体积2mol·L-1的某酸溶液后,混合溶液的pH一定会减小C.pH相同的...” 主要考查您对水的电离平衡
溶液的酸碱性
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 水的电离平衡
- 溶液的酸碱性
水的电离:
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O
 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L 注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
溶液的酸碱性:
(1)pH=-lg[c(H+)],在溶液的c(H+)很小时,用pH来表示溶液的酸度。
(2)pH越大,c(H+)越小,c(OH-)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
(3)pH的范围:0~14
(4)溶液酸碱性判断:
当c(H+)>c(OH-)时,溶液呈酸性;
当c(H+)>=c(OH-)时,溶液呈键性;
当c(H+)<c(OH-)时,溶液呈中性。
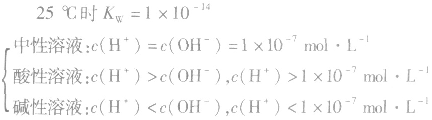
(5)关于pH相同的酸(含强酸和弱酸)
①溶液中c(H+)相等(填“相等”或“不等”)。
②溶液中溶质的物质的量的浓度:强酸<弱酸(填“>”或“<”)。
③耗碱规律:pH和溶液体积均相同的HCl、H2SO4、CH3COOH与碱完全反应时,消耗碱物质的量最多的是CH3COOH。
④稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m,强酸中c(H+)变为原来的1/m,但弱酸中c(H+)减小小于(填“大于”或“小于”)m倍,故稀释后弱酸酸性强于强酸。
(1)pH=-lg[c(H+)],在溶液的c(H+)很小时,用pH来表示溶液的酸度。
(2)pH越大,c(H+)越小,c(OH-)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
(3)pH的范围:0~14
(4)溶液酸碱性判断:
当c(H+)>c(OH-)时,溶液呈酸性;
当c(H+)>=c(OH-)时,溶液呈键性;
当c(H+)<c(OH-)时,溶液呈中性。
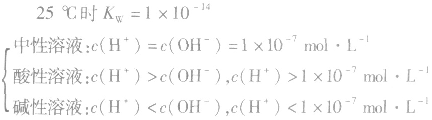
(5)关于pH相同的酸(含强酸和弱酸)
①溶液中c(H+)相等(填“相等”或“不等”)。
②溶液中溶质的物质的量的浓度:强酸<弱酸(填“>”或“<”)。
③耗碱规律:pH和溶液体积均相同的HCl、H2SO4、CH3COOH与碱完全反应时,消耗碱物质的量最多的是CH3COOH。
④稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m,强酸中c(H+)变为原来的1/m,但弱酸中c(H+)减小小于(填“大于”或“小于”)m倍,故稀释后弱酸酸性强于强酸。
溶液的pH:
1.定义:溶液里H+的物质的量浓度的负对数叫做pH。
2.表达式:
3.含义: pH越大,c(H+)越小,c(O-一)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
4.适用范围:
c(H+)很小时,用pH来表示溶液的酸碱度更方便。所以,pH适用于酸、碱的稀溶液
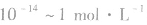 之间],pH取值范刚为0~14。
之间],pH取值范刚为0~14。
5.溶液的酸碱性和pH: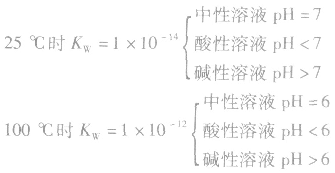
发现相似题
与“下列有关溶液的叙述正确的是[ ]A.常温下的醋酸铵溶液中c(H+)...”考查相似的试题有:
- 下列各溶液中,微粒的物质的量浓度关系正确的是 A.Na2CO3溶液:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)B.NH4Cl溶液:c(NH...
- 下图是用0.1000 mol·mol—1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答: ...
- 25℃时,把下列物质加入水中能促进水的电离的是( ) A.NaCl B.HCl C.NH4Cl D.KOH
- 常温下,向10mL0.1mol·L-1NaOH溶液中逐滴加入0.1mol·L-1醋酸溶液,所得滴定曲线如图所示。下列说法正确的是( )A.pH=7时...
- 对水的电离平衡不产生影响的粒子是( )A.Fe3+B.Cl-C.HClD.CH3COO-
- 下列操作中,能使电离平衡H2O⇌H++OH-,向右移动且溶液呈酸性的是( )A.向水中加入NaHSO4溶液B.向水中加入Al2(SO4)3溶液C...
- 两人用同一瓶标准盐酸滴定同一瓶NaOH溶液,甲将锥形瓶用NaOH待测液润洗后,使用水洗过的碱式滴定管取碱液于锥形瓶中,乙则用...
- 25℃时,KW=1.0×10—14;100℃时,KW=1×10—12 ,下列说法正确的是( ) A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4恰好中和,所得...
- 下图中a、b、c、d分别表示常温下NH4Cl、H2SO4、NaOH、NH3·H2O四种溶液在稀释过程中pH变化的曲线,请回答下列问题(1)写出曲线a...
- 常温下,①PH=10氨水 ②PH=10氢氧化钠溶液 ③PH=4 HA溶液 ④PH=4 HB溶液,对下列四种溶液的叙述正确的是[ ]A.②、④两溶液相比,两...