本试题 “下列有关实验的描述正确的是( )A.在空气中加热铁丝,铁丝火星四射B.镁条放入稀盐酸溶液中,反应后溶液温度降低C.电解水产生的氢气与氧气的体积比为l:8D...” 主要考查您对电解水实验
S,Fe,C,P等物质在氧气中的燃烧
化学反应中的能量变化
金属的化学性质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电解水实验
- S,Fe,C,P等物质在氧气中的燃烧
- 化学反应中的能量变化
- 金属的化学性质
电解就是将两根金属或碳棒(即电极)放在要分解的物质(电解质)中,然后接上电源,使电流通过液体。化合物的阳离子移到带负电的电极(阴极),阴离子移到带正电的电极(阳极),化合物分为二极。
电解过程
用电使化合物分解的过程就叫电解过程。
水(H2O)被电解生成电解水。电流通过水(H2O)时,氢气在阴极形成,氧气则在阳极形成。带正电荷的离子向阴极移动,溶于水中的矿物质钙、镁、钾、钠……带正电荷的离子,便在阴极形成,就是我们所喝的碱性水;而带负电的离子,在阴极生成。
电解水实验:
1.实验装置图:
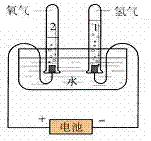
2.表达式:
水
 氢气+氧气
氢气+氧气2H2O
 2H2↑+O2↑
2H2↑+O2↑3.实验现象:
(1)通电后两电极上都有气泡产生;
(2)与电源正极相连接的一端产生的气体比连接负极一端产生的气体少,
接负极一端玻璃管中气体的体积是接正极一端玻璃管内气体体积的2倍。
4.产物检验
(1)正极一端的气体能使带火星的木条复燃,证明气体是氧气。
(2)负极一端的气体能燃烧,并看到微弱的淡蓝色火焰(或听到爆鸣声),
证明气体是氢气。
5.实验结论:
(1)水是由氢元素和氧元素组成的。
(2)1个水分子由2个氢原子和1个氧原子构成。
(3)化学变化中,分子可以再分,原子不可以再分。
6.注意事项:
(1)实验前在水中加入少量的氢氧化钠或者稀硫酸,可增强水的导电性,
加快反应速率。
(2)实验开始时产生的氧气和氢气的体积会小于1:2,是因为氢气难溶于水,
氧气不易溶于水,开始产生的氧气有一部分溶于水,实验时间越长,
其比值越接近1:2。
电解水记忆口诀:
水中通入直流电,正氧负氢会出现;氢二氧一体积比,任何时候都不变。
氧化的化学性质很活泼,很多物质都能与氧气发生化学反应。
部分物质在空气中和氧气中反应的对比:
a)碳和氧气反应
方程式:C + O2 CO2
CO2
现象:剧烈燃烧,发白光,放热,生成使澄清石灰水变浑浊的气体
b)硫和氧气反应
方程式:S + O2 SO2
SO2
现象:发出明亮的蓝紫色火焰,放热,生成有刺激性气味的气体
注意:实验前应在瓶底放少量水,用来吸收生成的有毒气体。
c)红磷和氧气反应:
方程式:4P + 5O2 2P2O5
2P2O5
现象:发出耀眼的白光,放热,生成大量白烟
生成的P2O5是固体小颗粒,现象为白烟,不是白雾。
d)铁和氧气的反应:
方程式:3Fe + 2O2 Fe3O4
Fe3O4
现象:剧烈燃烧,火星四射,放出热量,生成黑色物质
注意:集气瓶底放一层细沙或少量水。
e)镁和氧气反应:
方程式:2Mg + O2 2MgO
2MgO
现象:剧烈燃烧,发出耀眼的白光,放出热量,生成白色粉末状固体,有白烟。
注意:不能手持镁条,应用坩埚钳夹持。
f)石蜡和氧气反应
文字表达式:石蜡+氧气 水+二氧化碳
水+二氧化碳
现象:剧烈燃烧,放出热量,发出白光,如果在火焰上方罩一个干冷烧杯,
烧杯内壁有水珠,生成使澄清石灰水变浑浊的气体。
烟和雾的区别:
a)烟:大量固体小颗粒分散在空气长产生烟。红磷燃烧产生大量白烟,是燃烧生成的固体P2O5分散在空气中形成的
b)雾:大量小液滴分散在气体中产生雾。打开盛浓盐酸的瓶塞,瓶口有白雾,是挥发的HCl气体遇到空气中的水蒸气形成了盐酸小液滴。
a)光:固体物质燃烧使发光。镁条燃烧发出耀眼的强光,木炭在氧气中燃烧产生白光
b)气体物质和容易气化的物质燃烧时产生火焰。蜡烛在氧气中燃烧产生白色的火焰,是石蜡熔化后生成的气体燃烧而产生的。
描述物质在氧气中燃烧的现象的技巧:
可按三个顺序从三个方面进行:
(1)剧烈燃烧,有什么颜色的光,火焰;
(2)放热;
(3)生成物的特性
化学反应不仅有物质的变化,还伴随着能量的变化,通常表现为热量变化。有些化学反应会放出热量(称为放热反应),如燃烧、镁和盐酸反应等;也有些反应会吸收热量(称为吸热反应),如碳与二氧化碳反应(C+CO2
 2CO)。
2CO)。 常见的吸热反应:
化学上把最终表现为吸收热量的反应叫吸热反应,初中化学所涉及的吸热反应主要有以下几种:
①C+CO2
 2CO
2CO C+2CuO
 2Cu+CO2↑
2Cu+CO2↑ CaCO3
 CaO+CO2↑
CaO+CO2↑ 3CO+Fe2O3
 2Fe+3CO2
2Fe+3CO2 可见,一般反应条件为高温的反应是吸热反应。
常见的放热反应:
化学上把最终表现为放出热量的反应叫放热反应,初中化学所涉及的放热反应主要有以下几种:
①燃烧:所有燃烧均会放热,如CH4+2O2
 CO2+2H2O,H2+Cl2
CO2+2H2O,H2+Cl2 2HCl;
2HCl;②酸碱中和:酸与碱反应生成盐和水,同时放出热量,如H2SO4+2NaOH==Na2SO4+2H2O
③活拨金属与酸发生置换反应生成H2,同时放出热量,如Mg+2HCl==MgCl2+H2↑,Zn+H2SO4== ZnSO4+H2↑。
④缓慢氧化也是放热反应,如铁生锈、食物腐烂过程中均放出热量。
⑤其他:如双氧水分解是放热反应
人类生活对能量的利用:
①生活燃料的利用:做饭、取暖等;
②利用燃料烧烧产生的能量:发电、制陶瓷、冶炼金属和发射火箭;
③利用爆炸产生的巨大能量:开山炸石、拆除违规建筑;
④食物在体内发生缓慢氧化放出热量,维持体温
常见金属能与氧气反应,也能与盐酸,硫酸及盐溶液反应。
常见金属的化学性质:
1.金属和氧气的反应
| 金属 | 在空气中 | 在氧气中 | 方程式 |
| 镁 | 常温下表面逐渐变暗。点燃 剧烈燃烧,发出耀眼的白光, 生成白色固体 |
点燃,剧烈燃烧,发出耀 眼的白光,生成白色固体 |
2Mg+O2 2MgO 2MgO |
| 铝 | 常温下,铝表而变暗,生成一 层致密氧化膜,保护铝不再被腐蚀 |
点燃。剧烈燃烧,火星四射, 放出大量的热,生成白色固体 |
4Al+3O2 2Al2O3 2Al2O3 |
| 铁 | 持续加热发红,离火变冷 | 火星四射,放出大量的热, 生成黑色固体 |
3Fe+2O2 Fe3O4 Fe3O4 |
| 铜 | 加热,生成黑色物质,在潮湿的 空气中,生成铜绿而被腐蚀 |
加热,生成黑色固体 | 2Cu+O2 2CuO 2CuO |
| 金 | 即使在高温也不和氧气反应 | —— | |
| 结论 | 大多数金属都能喝氧气反应,但反应的难易程度和剧烈程度不同 | ||
2.金属与酸的反应
| 盐酸 | 稀硫酸 | 反应现象(两种酸中相同) | |
| 镁 | Mg+2HCl==MgCl2+H2↑ | Mg+H2SO4==MgSO4+H2↑ | 反应比较剧烈,产生大量 气泡,溶液仍为无色,生成 的气体能够燃烧,并且产 生淡蓝色火焰 |
| 铝 | 2Al+6HCl==2AlCl3+3H2↑ | 2Al+3H2SO4==Al2(SO4)+3H2↑ | |
| 锌 | Zn+2HCl==H2↑+ZnCl2 | Zn+H2SO4==ZnSO4+H2↑ | 反应缓慢,有气泡产生,溶 液由无色逐渐变为浅绿色, 生成的气体能够燃烧,并且 产生淡蓝色火焰 |
| 铁 | Fe+2HCl==FeCl2+H2↑ | Fe+H2SO4==FeSO4+H2↑ | |
| 铜 | 不反应 | 不反应 | 无 |
3.金属与盐的反应
将锌片、铁丝、铜丝三种金属分别放入硫酸铜溶液、硝酸银溶液、氯化钠溶液中,观察现象
| CuSO4溶液 | AgNO3溶液 | NaCl溶液 | |
| 锌 | 锌表面有一层红色金属析出,溶液由蓝色变为无色 Zn+CuSO4==ZnSO4+Cu |
锌表面有一层银白色金属析出 Zn+2AgNO3==Zn(NO3)2+2Ag |
无变化,不反应 |
| 铁 | 铁表面有一层红色金属析出,溶液由蓝色变为浅绿色 Fe+CuSO4==FeSO4+Cu |
铁表面有一层银白色金属析出,溶液由无色变为浅绿色 Fe+2AgNO3==Fe(NO3)2+2Ag |
无变化,不反应 |
| 铜 | 无变化,不反应 | 铜表面有一层银白色金属析出,溶液由无色变为蓝色 Cu+2AgNO3==Cu(NO3)2+2Ag |
无变化,不反应 |
易错点:
一、(1)一般在金属活动性顺序表中排在氢前面的金属(也叫活泼金属)能置换出酸中的氢;排在氢后面的金属则不能,如铜、银与盐酸、稀硫酸都不反应。
(2)浓硫酸和硝酸与金属反应不生成氢气,因为它们有很强的氧化性,与金属反应不生成氢气。
(3)在金属活动性顺序表中排在最前面的金属如K、 Na活泼性太强,放入酸溶液中首先跟酸发生置换反应,过M的金属会继续跟水发生剧烈的反应。
(4)铁与非氧化性酸反应时,始终生成亚铁盐 (Fe2+)。
(5)金属与酸反应后溶液的质量增大。
二、
(1)在金属活动性顺序表中,位于前面的金属可以把位于其后面的金属从它们的盐溶液中置换出来(K,Ca,Na除外)。相隔越远,反应越容易发生。
(2)金属与盐溶液的反应,盐必须能溶于水,不溶性的盐与金属不反应,如AgCl难溶于水,Fe和AgCl不反应。
(3)不能用活泼的金属K,Ca,Na,与盐溶液反应,因为K,Ca,Na。会先与H2O发生置换反应生成碱和氢气。
金属与酸的反应不一定属于置换反应:
置换反应是指一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。一般情况下,较活泼的金属跟酸发生的化学反应属于置换反应。但由于浓硫酸(或硝酸)具有强氧化性,金属与浓硫酸(或硝酸)反应时,生成物相对比较复杂。这类反应不属于置换反应。
铝和锌的抗腐蚀性:
1.铝制品具有很好的抗腐蚀性,是因为铝与空气中的氧气反应表面生成一种致密的氧化铝薄膜,对铝起防护作用。
2.锌与铝的抗腐蚀性相似,也是在金属表面会生成一层致密的氧化锌保护膜。
与“下列有关实验的描述正确的是( )A.在空气中加热铁丝,铁丝...”考查相似的试题有:
- 人类离不开水,自来水生产中通入氯气的作用是 ;家用净水器中装有活性炭,是因为它具有 性。图一是电解水的实验装置,电源A端...
- 如图所示的是电解水实验装置.通电一段时间后,在两个试管中分别收集到气体a和气体b.请回答:(1)电解水时,将______转化为...
- (4分)人类文明进步与金属材料发展关系十分密切,金属在生活生产中有着非常广泛的应用。(1)下列三种金属被发现、使用的先...
- 下列对实验现象的叙述中正确的是( )A.细铁丝在氧气中剧烈燃烧,火星四射,生成四氧化三铁B.硫在氧气中燃烧产生淡蓝色火焰...
- 下列物质可以由金属跟酸反应直接得到的是( )A.CuCl2B.FeCl3C.AgClD.MgCl2
- 铁丝在氧气中燃烧的主要现象是( )A.产生大量白烟B.火星四射,有黑色固体生成C.燃烧的火焰为蓝色D.产生有刺激性气味的气体
- 下列物质在氧气中燃烧的有关现象,其中描述错误的是( )A.铁丝--火星四射B.硫粉--蓝紫色火焰C.镁条--耀眼白光D.红磷--浓...
- 关于化学反应与能量变化的叙述不正确的是( )A.在化学反应中只有燃烧才能放出热量B.物质的缓慢氧化均放出热量C.物质发生...
- 将一根洁净的铁丝放硫酸铜溶液中,下列叙述正确的是( )A.溶液由蓝色变成红色B.铁丝表面有红色物质生成C.铁丝表面有气泡...
- 下列化学方程式正确的是( )A.2Fe+6HCl=2FeCl3+3H2↑B.CuSO4+2NaOH=Cu(OH)2↓+Na2SO4C.CaCO3+HCl=CaCl+CO2↑+H2OD.Mg+O2 ...