本试题 “(1)Na2CO3溶液呈碱性的原因是______(写出有关的离子方程式),(NH4)2SO4溶液呈酸性的原因是______(写出有关的离子方程式),将NaHCO3溶液跟Al2(SO4)3...” 主要考查您对盐类水解的定义
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 盐类水解的定义
盐类水解:
1.定义:在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类水解。
2.实质:生成弱电解质,使水的电离平衡被破坏而建立新的平衡。
3.条件:盐中必须有弱酸根离子或弱碱阳离子,盐溶于水。
4.特点:可逆性,写水解离子方程式时要用“ ” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
5.规律:有弱才水解,无弱不水解。谁弱谁水解,谁强显谁性。越弱越水解,都弱都水解。例如:25℃时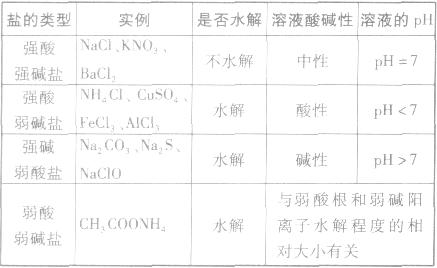
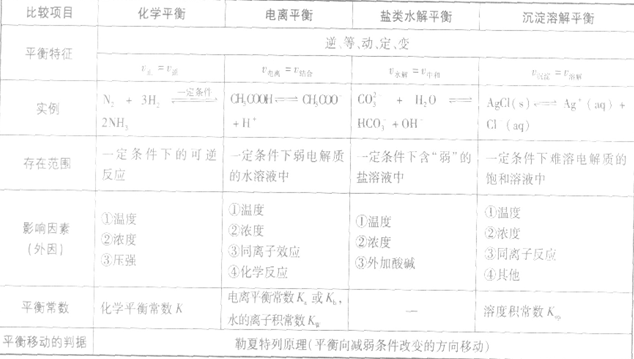
四种重要的动态平衡的比较:
发现相似题
与“(1)Na2CO3溶液呈碱性的原因是______(写出有关的离子方程式...”考查相似的试题有:
- 已知H2PO以电离为主。在0.1mol·L-1的NaH2PO4溶液中,下列粒子浓度关系不正确的是()A.c(Na+)+c(H+)=c(OH-)+c(H2PO)+2c(HPO)+...
- 下列离子方程式正确的是( )A.用碳酸钠溶液吸收少量二氧化硫:2+H2O+SO2====2+B.碳酸氢铵溶液的电离方程式:H++C.向含有2 m...
- 己知0.1mol/LNaHCO3溶液显碱性,将此溶液加水稀释后,下列说法正确的是( )A.稀释后,溶液中各离子浓度均变小。B.原溶液中...
- 下列关于常温下电解质溶液的叙述中,正确的是( )A.碳酸氢铵溶液和足量的氢氧化钠溶液混合的离子反应:HCO3-+OH-=CO32-+H2O...
- I、(1)NaHCO3是一种______(填“强”或“弱”)电解质;(2)写出HCO3-水解的离子方程式:______;(3)常温下,0.1mol•L-1NaHC...
- 常温下,若等物质的量浓度的HA溶液和NaOH溶液混合后pH=7,下列说法合理的是( )A.反应后HA溶液一定没有剩余B.生成物NaA的...
- 为探究某种盐的水解是吸热反应。有四位同学分别设计了如下实验方案:同学实验设计甲将硝酸铵晶体溶于水,若水温下降,说明硝...
- 下列说法错误的是( )A.向Na2S 溶液中滴入酚酞试液,呈红色B.升高温度能使FeCl3溶液中c(H+)增大C.一切钾盐,钠盐,硝酸盐都不...
- 10分)(1)现有0.1 mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,正确的操作是 __________。纯碱溶液呈碱性的原因(用离子方...
- 25 ℃时,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L混合溶液。(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程...