本试题 “(1)配位化学创始人维尔纳发现,取COCl3•6NH3(黄色)、CoCl3•5NH3(紫红色)、COCl3•4NH3(绿色)和COCl3•4NH3(紫色)四种化合物各1mol,分别溶于水,加入...” 主要考查您对配合物理论
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 配合物理论
配位键、配合物:
1.配位键配位键是一种特殊的共价键。成键的两个原子间的共用电子对是由一个原子单独提供的。形成配位键的条件是其中一个原子有孤电子对,另一个原子有接受孤电子对的“空轨道”。配位键用A→B表示,A是提供孤电子对的原子,B是接受孤电子对的原子。
2.配合物通常把金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物称为配合物。
3.配位键的形成
(1) 中配位键的形成
中配位键的形成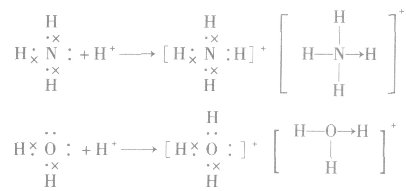
注意:结构式中“→”表示配位键及其共用电子对的提供方式。
(2)配离子 中配位键的形成
中配位键的形成
在 里,NH3分子中的氮原子给出孤电子对,
里,NH3分子中的氮原子给出孤电子对,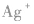 接受电子对,以配位键形成了
接受电子对,以配位键形成了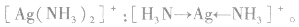
(3)配离子 的形成
的形成
在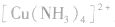 里,
里, 分子中的氮原子给出孤电子对,
分子中的氮原子给出孤电子对, 接受电子对,以配位键形成了
接受电子对,以配位键形成了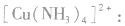
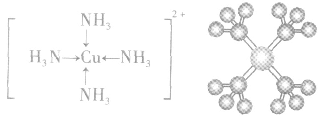
4.配合物的组成
配合物的组成包含中心原子、配体和配位原子、配位数,内界和外界等。以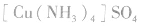 为例说明,如下图所示:
为例说明,如下图所示: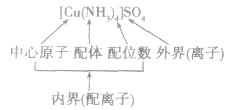
配合物的内界和外界之间多以离子键结合,因而属于离子化合物、强电解质,能完全电离成内界离子和外界离子,内界离子也能电离但程度非常小,可谓“强中有弱”。例如,配合物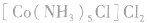 溶液中加入
溶液中加入 溶液,外界的
溶液,外界的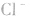 能被沉淀,而内界的
能被沉淀,而内界的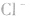 不能形成沉淀。
不能形成沉淀。
发现相似题
与“(1)配位化学创始人维尔纳发现,取COCl3•6NH3(黄色)、CoCl...”考查相似的试题有:
- 四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。(1)写出B原子的电子排布式____________。(2)A元素的氢化物的...
- 配位化学创始人维尔纳发现,将分别为1 mol的 CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、CoCl3·4NH3(绿色)、CoCl3·4NH3(...
- 0.01mol氯化铬(CrCl3•6H2O)在水溶液中用过量AgNO3处理,产生0.02mol AgCl沉淀,此氯化铬最可能为( ) A.[Cr(H2O)6]Cl3 ...
- 镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时, 先制备无水氯化镁,然后将其熔融电解,得到金属镁。(1...
- 【二选一—物质结构与性质】碳、氧、铁、铜等是与人类生产、生活息息相关的化学元素。(1)基态铜原子的价电子排布式为_______...
- 决定物质性质的重要因素是物质结构.请回答下列问题.(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:电...
- 一水硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4•H2O]是一种重要的染料及农药中间体.请回答下列相关问题:(1)Cu的核外电子排布式...
- (1)向黄色的FeCl3溶液加入无色的KSCN溶液,溶液变成血红色:FeCl3+3KSCN=Fe(SCN)3+3KCl。向上述血红色溶液中加入NaF溶液振荡...
- 下列说法中错误的是( )A.根据对角线规则,铍和铝的性质具有相似性B.在H3O+、NH4+ 和[Cu(NH3)4]2+中都存在配位键C.元素...
- 四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。(1)写出B原子的电子排布式________。(2)A元素的氢化物的沸点...