本试题 “0.01mol氯化铬(CrCl3•6H2O)在水溶液中用过量AgNO3处理,产生0.02mol AgCl沉淀,此氯化铬最可能为( ) A.[Cr(H2O)6]Cl3 B.[Cr(H2O)5Cl]Cl2•H2O C.[C...” 主要考查您对配合物理论
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 配合物理论
配位键、配合物:
1.配位键配位键是一种特殊的共价键。成键的两个原子间的共用电子对是由一个原子单独提供的。形成配位键的条件是其中一个原子有孤电子对,另一个原子有接受孤电子对的“空轨道”。配位键用A→B表示,A是提供孤电子对的原子,B是接受孤电子对的原子。
2.配合物通常把金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物称为配合物。
3.配位键的形成
(1) 中配位键的形成
中配位键的形成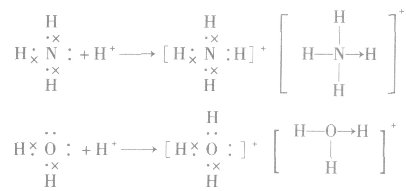
注意:结构式中“→”表示配位键及其共用电子对的提供方式。
(2)配离子 中配位键的形成
中配位键的形成
在 里,NH3分子中的氮原子给出孤电子对,
里,NH3分子中的氮原子给出孤电子对,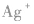 接受电子对,以配位键形成了
接受电子对,以配位键形成了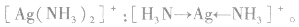
(3)配离子 的形成
的形成
在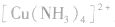 里,
里, 分子中的氮原子给出孤电子对,
分子中的氮原子给出孤电子对, 接受电子对,以配位键形成了
接受电子对,以配位键形成了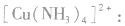
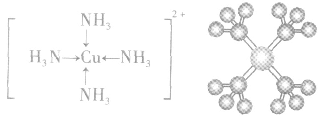
4.配合物的组成
配合物的组成包含中心原子、配体和配位原子、配位数,内界和外界等。以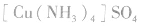 为例说明,如下图所示:
为例说明,如下图所示: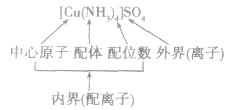
配合物的内界和外界之间多以离子键结合,因而属于离子化合物、强电解质,能完全电离成内界离子和外界离子,内界离子也能电离但程度非常小,可谓“强中有弱”。例如,配合物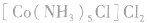 溶液中加入
溶液中加入 溶液,外界的
溶液,外界的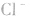 能被沉淀,而内界的
能被沉淀,而内界的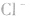 不能形成沉淀。
不能形成沉淀。
发现相似题
与“0.01mol氯化铬(CrCl3•6H2O)在水溶液中用过量AgNO3处理,产...”考查相似的试题有:
- 研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题(1)C、Si、N元素的电负性由大到小的顺序是____________...
- Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z的原子序数为29,其余的均为短周期主族元素;②Y原子价电子(外围电子)排...
- 下列说法中错误的是[ ]A.当中心原子的配位数为6时,配合单元常呈八面体空间结构B.[Ag(NH3)2]+中Ag+空的5s轨道和5p轨道以sp...
- 一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。(1)向一定物质的量浓度的Cu(NO...
- 下表为长式周期表的一部分,其中的编号代表对应的元素。请回答下列问题(1)表中属于d区的元素是________________(填编号)...
- 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A试回答下列问题:(答题时,A、B、C、D、E、F用所对应的元...
- 金属镍及其化合物在合金材料以及催化剂等方面应用广泛.(1)基态Ni原子的价电子(外围电子)排布式为______;(2)金属镍能...
- PtCl4•2NH3水溶液不导电加入AgNO3无现象加强碱无NH3放出下列说法正确的是( ) A.配合物中中心原子的电荷数和配位数均为6 B...
- 下列各种说法中错误的是[ ]A.形成配位键的条件是一方有空轨道,一方有孤电子对B.配位键是一种特殊的共价键C.配位化合物中的配...
- 下列有关说法不正确的是[ ]A.水合铜离子的模型如图(1)所示,1个水合铜离子中有4个配位键B.CaF2晶体的晶胞如图(2)所示,每个...