本试题 “逻辑推理是化学学习常用的思维方法。下列推理正确的是[ ]A. 酸性溶液的pH都小于7,所以酸溶液pH一定小于7B. 有机物都含有碳元素,所以含有碳元素的化合物都是...” 主要考查您对纯净物和混合物
有机化合物和无机化合物
溶液的酸碱性与pH值
中和反应及在实际中的应用
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 纯净物和混合物
- 有机化合物和无机化合物
- 溶液的酸碱性与pH值
- 中和反应及在实际中的应用
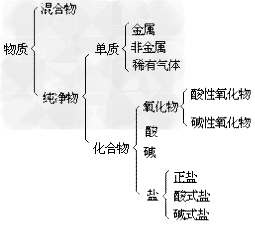
混合物:
(1)概念:由两种或多种物质混合而成的物质,没有有固定的组成,各成分保持自己原有的化学性质。
(3)常见的混合物:空气、合金、矿石、溶液等。
(4)混合物的提纯:混合物经过物理或化学的方法可以提纯。
纯净物:
(1)概念:只由一种物质组成的物质。
(3)纯净物的分类:纯净物根据物质组成的元素种类,分为两大类:单质和化合物。
纯净物和氧化物的区别:
| 纯净物 | 混合物 | |
| 概念 | 宏观:由一种物质组成的物质 微观:由同种分子构成(对于由分子构成的物质而言) |
宏观:由两种或多种物质组成的物质 微观:由不同种分子构成(对于由分子构成的物质而言) |
| 区别 | 由同种物质组成(对于由分子构成的物质,是由同种分子构成的),组成是固定的 | 由不同种物质组成(对于由分子构成的物质. 是由不同种分子构成的),组成是不固定的 |
| 特点 | ①具有固定的组成 ②具有一定的性质 ③有专门的化学符号 |
①没有固定的组成和性质 ②各成分保持各自的性质 ③没有专门的化学符号 |
| 分离方法 | 组成固定,不需分离;若需将化合物分成几种单质,则必须通过化学方法才能实现 | 物理方法: 筛选 过滤 蒸馏 |
| 实例 | 氧气,二氧化碳,高锰酸钾 | 空气,粗盐,蔗糖水 |
| 联系 | 纯净物是相对而言的,自然界中绝对纯净的物质是不存在的,通常的纯净物是指含杂质很少的具有高纯度的物质。两者间的关系为 | |
对纯净物和混合物概念的理解:
(1)混合物概念:混合物可以看作是由几种纯净物混合而成的,混合物的形成过程中发生的是物理变化。由于混合物的组成一般不固定,所以往往不能用化学式表示。
(2)纯净物概念:纯净物只由一种物质组成,有固定的组成.可以用化学式表示。
常考的纯净物与混合物:
(1)混合物:石油、煤、天然气、洁净的空气、生理盐水、矿泉水、汽水、碘酒、白酒、双氧水、盐酸、合金等都是混合物。
(2)纯净物:水银、烧碱、纯碱、胆矾、液态氧、液态氮、蒸馏水(纯水)、干冰、冰水共存物、金刚石、石墨、生石灰、熟石灰、氯化钠、氧化铁等都是纯净物:
物质的分类示意图:
有机化合物:
(1)概念:通常人们将含有碳元素的化合物称为有机化合物,简称有机物,如甲烷、乙醇、葡萄糖、淀粉等。
(2)组成和结构:有机物都含碳元素,多数含有氢元素,可能还含有氧、氮、氯、硫、磷等元素。有机物中碳原子不仅可以和H,O,Cl,,N等原子直接结合,而且碳原子之间也可以互相连接成链状或环状。原子的排列方式不同,形成有机物的结构就不同,所表现出来的性质也不同。
(3)特点:大多数有机化合物都难溶于水,易溶于有机溶剂,大多数有机化合物受热易分解,且容易燃烧,燃烧产物有CO2和水;绝大多数有机化合物不易导电、熔点低。
(4)分类:
①有机物小分子:相对分了质量较小,如乙醇,甲烷、葡萄糖等。
②有机高分子化合物:简称有机高分子,其相对分子质量比较大,从几万到几十万,甚至高达几百万或更高,如淀粉、蛋白质等。
无机化合物:
(1)概念:无机化合物简称无机物,通常指不含碳元素的化合物,但少数含碳元素的化合物,如CO,CO2, H2CO3,CaCO3等,不具有有机化合物的特点,归在无机化合物中。
(2)分类:无机化合物根据元素组成及在水中离解成的粒子特点分为氧化物、酸、碱,盐。
有机化合物与无机化合物的主要区别:
概念的理解:
像NaCl、H2SO4和NaOH等不含碳元素的化合物称为无机化合物,而少数含碳元素的化合物,如CO,CO2和CaCO3等虽然含有碳元素,但具有无机化合物的特点,也把它们看作无机化合物。有机物一定含有碳元素,但含有碳元素的化合物不一定是有机物。含有碳元素但不属于有机物的化合物主要包括: 碳的氧化物、碳酸、碳酸盐和碳酸氢盐。
(1)概念:通常人们将含有碳元素的化合物称为有机化合物,简称有机物,如甲烷、乙醇、葡萄糖、淀粉等。
(2)组成和结构:有机物都含碳元素,多数含有氢元素,可能还含有氧、氮、氯、硫、磷等元素。有机物中碳原子不仅可以和H,O,Cl,,N等原子直接结合,而且碳原子之间也可以互相连接成链状或环状。原子的排列方式不同,形成有机物的结构就不同,所表现出来的性质也不同。
(3)特点:大多数有机化合物都难溶于水,易溶于有机溶剂,大多数有机化合物受热易分解,且容易燃烧,燃烧产物有CO2和水;绝大多数有机化合物不易导电、熔点低。
(4)分类:
①有机物小分子:相对分了质量较小,如乙醇,甲烷、葡萄糖等。
②有机高分子化合物:简称有机高分子,其相对分子质量比较大,从几万到几十万,甚至高达几百万或更高,如淀粉、蛋白质等。
无机化合物:
(1)概念:无机化合物简称无机物,通常指不含碳元素的化合物,但少数含碳元素的化合物,如CO,CO2, H2CO3,CaCO3等,不具有有机化合物的特点,归在无机化合物中。
(2)分类:无机化合物根据元素组成及在水中离解成的粒子特点分为氧化物、酸、碱,盐。
氧化物,酸,碱,盐的比较:
| 物质类别 | 概念 | 分类 |
| 氧化物 | 由两种元素组成,期中一种是氧元素 | 金属氧化物:由金属元素与氧元素组成,如MgO,Fe2O3等 非金属氧化物:由非金属元素与氧元素组成,如CO2、SO2、H2O等 |
| 酸 | 能离解成氢离子和酸根离子的化合物 | 含氧酸:如H2SO4、H2CO3、HNO3等无氧酸:如HCl,H2S等 |
| 碱 | 由金属离子和氢氧根离子构成的化合物 | 可溶性碱:如NaOH,Ca(OH)2等不溶性碱:如Mg(OH)2、 Fe(OH)3等 |
| 盐 | 由金属离子(或铵根离子)和酸根离子构成的化合物 | 正盐:如NaCl、NH4Cl、Na2CO3,仅由金属离子或钱根离子和酸根离子两部分组成酸式盐:如NaHCO3、NH4HCO3,由金属离子或铵根离子、酸式酸根离子构成碱式盐;如Cu2(OH)2CO3,由金属离子、酸根离子和氢氧根离子构成 |
有机化合物与无机化合物的主要区别:
| 有机化合物 | 无机化合物 | |
| 溶解性 | 多数不溶于水。易溶于有机溶剂 | 有些溶于水而不溶于有机溶剂 |
| 耐热性 | 多数不耐热。熔点较低,一般在400℃ 以下 | 多数耐热,难熔化,熔点一般比较高 |
| 可燃性 | 多数可以燃烧 | 多数不能燃烧 |
概念的理解:
像NaCl、H2SO4和NaOH等不含碳元素的化合物称为无机化合物,而少数含碳元素的化合物,如CO,CO2和CaCO3等虽然含有碳元素,但具有无机化合物的特点,也把它们看作无机化合物。有机物一定含有碳元素,但含有碳元素的化合物不一定是有机物。含有碳元素但不属于有机物的化合物主要包括: 碳的氧化物、碳酸、碳酸盐和碳酸氢盐。
溶液的酸碱度及表示方法
1. 溶液的酸碱性:溶液呈酸性、碱性或中性,通常用指示剂来测定。
2. 溶液的酸碱度:指溶液酸碱性的强弱程度,即酸碱度是定量表示溶液酸碱性强弱的一种方法.溶液的酸碱度通常用pH表示。
3. pH的范围:0—14
溶液酸碱度和pH值的关系
| 溶液的pH值 | 溶液的酸碱度 |
| <7 | 酸性溶液(pH越小,酸性越强) |
| =7 | 中性溶液 |
| >7 | 碱性溶液(pH越大,碱性越大) |
(2)粗略测定溶液的酸碱度常用pH试纸。
pH的测定方法:
测定溶液pH通常用pH试纸和pH计。其中用pH试纸测定溶液pH的具体操作为:测定时,将pH试纸放在表面皿上,用干净的玻璃棒蘸取被测溶液并滴在pH试纸上,半分钟后把试纸显示的颜色与标准比色卡对照,读出溶液的pH,简记为:“一放、二蘸、三滴、四比”。
改变溶液pH的方法:
溶液的pH实质是溶液中H+浓度或OH-浓度大小的外在表现。改变溶液中H+浓度或OH-浓度,溶液的pH就会发生改变。
方法一加水:只能改变溶液的酸碱度,不能改变溶液的酸碱性,即溶液的pH只能无限地接近于7。
①向酸性溶液中加水,pH由小变大并接近7,但不会等于7,更不会大于7(如下图所示)。
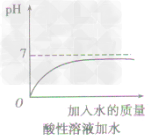
②向碱性溶液中加水,pH由大变小并接近于7,但不会等于7,更不会小于7(如下图所示)。

方法二加酸碱性相同,pH不同的溶液:原溶液酸碱性不会发生变化,但混合后溶液的pH介于两种溶液之间:
方法三加酸碱性相反的溶液:混合后发生中和反应,溶液的pH可能等于7,若加入的溶液过量,原溶液的酸碱性就会与原来相反(如下图所示)。

pH值测定时的注意事项:
①不能直接把pH试纸浸入待测的溶液中,以免带入杂质,同时还可能溶解pH试纸上的一部分指示剂,致使比色时产生较大误差。
②不能先用水将pH试纸润湿再进行测定。因为将待测溶液滴到用水润湿后的pH试纸上,其溶质质量分数将变小。
③用pH试纸测得溶液的pH一般为整数。
了解溶液的酸碱度的重要意义:
①化工生产中许多反应必须在一定pH溶液里才能进行;
②在农业生产中.农作物一般适宜在pH为7或接近于7的土壤中生长;
③测定雨水的pH(因溶解有二氧化碳,正常雨水的pH约为5.6,酸雨的pH小于5.6),可以了解空气的污染情况;
④测定人体内或排出的液体的pH,可以了解人体的健康状况。
身边一些物质的pH:

中和反应:
(1)定义:酸跟碱作用生成盐和水的反应,叫做中和反应。
(2)实质:酸中的氢离子与碱中的氢氧根离子作用生成水的过程。
概念理解:
①中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应。如Fe2O3+6HCl==2FeCl3+3H2O不是中和反应
②中和反应一定是复分解反应,但复分解反应不一定是中和反应。二者的关系是复分解反应包含了中和反应。
探究中和反应是否发生的方法:
酸与碱作用生成盐和水的反应叫中和反应,中和反应一般情况下没有明显的外观现象【H2SO4+ Ba(OH)2==BaSO4↓+2H2O除外】。
探究酸碱发生中和反应的方法有以下几种(以HCl和NaOH反应为例):
1. 指示剂法。先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
2. pH试纸法。先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时多次测定混合溶液的pH。如果测得pH逐渐变小且小于7,则证明 NaOH溶液与稀盐酸发生了化学反应。
3. 热量变化法。化学反应通常伴随着能量的变化.所以可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
中和反应的应用:
①改变土壤的酸碱性根据土壤情况,可以利用中和反应,在土壤中加人适量酸性或碱性物质,调节土壤的酸碱性,以利于植物生长。如:近年来由于空气污染造成的酸雨,导致一些地方的土壤显酸性,不利于农作物生长,人们通常向土壤中撒适量熟石灰中和其酸性。
②处理工厂的废水工厂里排出的废水有一些显酸性或碱性,直接排放会对水体和环境造成污染。通常在排出的废水中加入适量的碱性或酸性物质中和。如:废水中含有硫酸可向其中加人适从熟石灰,反应的化学方程式为:H2SO4+Ca(OH)2==CaSO4+2H2O。
③用于医药人体胃酸(主要成分是盐酸)过多,会造成消化不良,甚至会产生胃病,通常服用呈碱性的物质来消除症状,如氢氧化铝,反应的化学方程式为:3HCl+Al(OH)3== AlCl3+3H2O。被蚊虫叮咬(蚊虫能分泌出蚁酸)后,可在患处涂上显碱胜的物质,如:NH3·H2O。
(1)定义:酸跟碱作用生成盐和水的反应,叫做中和反应。
(2)实质:酸中的氢离子与碱中的氢氧根离子作用生成水的过程。
概念理解:
①中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应。如Fe2O3+6HCl==2FeCl3+3H2O不是中和反应
②中和反应一定是复分解反应,但复分解反应不一定是中和反应。二者的关系是复分解反应包含了中和反应。
探究中和反应是否发生的方法:
酸与碱作用生成盐和水的反应叫中和反应,中和反应一般情况下没有明显的外观现象【H2SO4+ Ba(OH)2==BaSO4↓+2H2O除外】。
探究酸碱发生中和反应的方法有以下几种(以HCl和NaOH反应为例):
1. 指示剂法。先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
2. pH试纸法。先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时多次测定混合溶液的pH。如果测得pH逐渐变小且小于7,则证明 NaOH溶液与稀盐酸发生了化学反应。
3. 热量变化法。化学反应通常伴随着能量的变化.所以可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
中和反应的应用:
①改变土壤的酸碱性根据土壤情况,可以利用中和反应,在土壤中加人适量酸性或碱性物质,调节土壤的酸碱性,以利于植物生长。如:近年来由于空气污染造成的酸雨,导致一些地方的土壤显酸性,不利于农作物生长,人们通常向土壤中撒适量熟石灰中和其酸性。
②处理工厂的废水工厂里排出的废水有一些显酸性或碱性,直接排放会对水体和环境造成污染。通常在排出的废水中加入适量的碱性或酸性物质中和。如:废水中含有硫酸可向其中加人适从熟石灰,反应的化学方程式为:H2SO4+Ca(OH)2==CaSO4+2H2O。
③用于医药人体胃酸(主要成分是盐酸)过多,会造成消化不良,甚至会产生胃病,通常服用呈碱性的物质来消除症状,如氢氧化铝,反应的化学方程式为:3HCl+Al(OH)3== AlCl3+3H2O。被蚊虫叮咬(蚊虫能分泌出蚁酸)后,可在患处涂上显碱胜的物质,如:NH3·H2O。
发现相似题
与“逻辑推理是化学学习常用的思维方法。下列推理正确的是[ ]A. ...”考查相似的试题有:
- 在下图的横线上依次填写有关铝的3个信息。
- 下图是稀盐酸和碳酸氢钠溶液反应的微观模拟图,请从微观角度回答下列问题:(1)请在图中标出反应后水分子的个数;(2)此变...
- 下列各组物质按混合物、纯净物、单质、化合物分类正确的是( )A.空气、糖水、一氧化碳、铁粉B.空气、水、金刚石、氯酸钾C...
- 水是一种重要的自然资源,与人类和生物的生存、工农业生产息息相关,对以下有关水的认识或观点,你认为正确的是______.A、比...
- 下列关于Fe、Fe2+的说法中,正确的是A.它们的核外电子数相同B.它们的质子数相同C.它们的最外层电子数相同 D.它们的性质完...
- 在化学学习和研究中分析推理是常用的思维方法.请你判断下列分析推理,正确的是( )A.有机物中都含有碳元素,所以含碳元素...
- 向稀盐酸中逐渐加水稀释,下列图象正确的是( )A.B.C.D.
- (2014届北京市丰台区第一学期期末)下列实验方案中,能达到实验目的的是选项实验目的实验方案A鉴别软水和硬水分别加入食盐水...
- 小何进行盐酸和氢氧化钠中和反应的实验,在向烧杯中的氢氧化钠溶液滴加了一定量的稀盐酸后,才发现忘记了加入指示剂。为了判...
- 在一定质量的甲溶液中逐渐加入乙至过量,反应过程中溶液的总质量与加入乙的质量的关系,能用右下图曲线表示的是 ( )序号甲乙①...