本试题 “已知Ksp(PbCrO4)=2.8×10-13mol2·L-2, Ksp(CaCrO4) =7.1×10-4mol2·L-2,向Pb2+、Ca2+的混合溶液(Pb2+、Ca2+的浓度均为0. 10 mol·L-1)中滴加K2CrO4溶 液,则...” 主要考查您对溶度积常数
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 溶度积常数
溶度积常数:
在AgCl(s)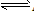 Ag+(aq)+Cl-(aq)中,当溶解速率与结晶速率相等时,达到平衡状态,Ksp(AgCl)=[ Ag+][ Cl-]为一常数,该常数称为难难溶电解质的溶度积常数,简称溶度积。用Ksp表示
Ag+(aq)+Cl-(aq)中,当溶解速率与结晶速率相等时,达到平衡状态,Ksp(AgCl)=[ Ag+][ Cl-]为一常数,该常数称为难难溶电解质的溶度积常数,简称溶度积。用Ksp表示
(1)溶度积的通式: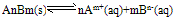 ,
,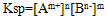
(2)溶度积规律:
①离子积: ,
,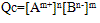
Qc为离子积,表达式中离子浓度是任意的,为此瞬间溶液的实际浓度,其值不确定,但对一难溶电解质,在一定温度下,Ksp为一定值。
②溶度积规则:
A. 当Qc>Ksp时,沉淀从溶液中析出来,体系不断析出沉淀,直至达到平衡(此时Qc=Ksp)
B. 当Qc=Ksp时,沉淀于饱和溶液平衡
C. 当Qc<Ksp时,溶液不饱和,若体系中有沉淀,则沉淀会溶解直至平衡(此时Qc=Ksp)。
在AgCl(s)
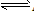 Ag+(aq)+Cl-(aq)中,当溶解速率与结晶速率相等时,达到平衡状态,Ksp(AgCl)=[ Ag+][ Cl-]为一常数,该常数称为难难溶电解质的溶度积常数,简称溶度积。用Ksp表示
Ag+(aq)+Cl-(aq)中,当溶解速率与结晶速率相等时,达到平衡状态,Ksp(AgCl)=[ Ag+][ Cl-]为一常数,该常数称为难难溶电解质的溶度积常数,简称溶度积。用Ksp表示(1)溶度积的通式:
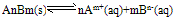 ,
,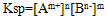
(2)溶度积规律:
①离子积:
 ,
,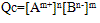
Qc为离子积,表达式中离子浓度是任意的,为此瞬间溶液的实际浓度,其值不确定,但对一难溶电解质,在一定温度下,Ksp为一定值。
②溶度积规则:
A. 当Qc>Ksp时,沉淀从溶液中析出来,体系不断析出沉淀,直至达到平衡(此时Qc=Ksp)
B. 当Qc=Ksp时,沉淀于饱和溶液平衡
C. 当Qc<Ksp时,溶液不饱和,若体系中有沉淀,则沉淀会溶解直至平衡(此时Qc=Ksp)。
发现相似题
与“已知Ksp(PbCrO4)=2.8×10-13mol2·L-2, Ksp(CaCrO4) =7.1×10-4m...”考查相似的试题有:
- 已知Ksp(Ag2S)=1.6×10-49,Ksp(CuS)=6.3×10-36,Ksp(PbS)=8×10-28,则推断可以实现的沉淀转化关系为________________。
- 已知:Ksp(RCl)=1.8×10-10,Ksp(RI)=1.5×10-16,Ksp(R2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,R+浓度大小顺序正确的...
- 向50 mL 0.018 mol/L的AgNO3溶液中加入50 mL0.02 mol/L的盐酸生成沉淀。已知:Ksp(AgCl)=1.8×10-10,则生成沉淀后的溶液中c(A...
- 对于难溶盐MX,若饱和溶液中M+和X-的物质的量 浓度之间的关系类似于c(H+)·c(OH-)= KW,存在等式 c(M+)·c(X-)= Ksp。现将足量...
- 如图:横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-物质的量浓度的对数,回答下列问题。(1)往ZnCl2溶液中加入足量的氢氧化钠...
- 下列推断或表述正确的是[ ]A.醋酸溶液的pH =a,将此溶液稀释1倍后,溶液的pH =b,则a>bB.向2.0 mL浓度均为0.1 moI·L-1的KCl...
- 已知:Ksp(Ag2SO4)=1.4×10-5mol3.L-3,Ksp(Ag2CO3)=8.1×10-12mol3.L-3,K sp( AgCl)=1.8×10-10mol2.L-2,Ksp (AgI)=8.3×10-1...
- 工业上通常把溶液中存在的CO32-和HCO3-的总浓度称为总碱度。水中碱度的控制成为碳酸钠软化水处理 法的关键。碳酸在水中一般以...
- 以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(...
- 向50mL 0.018mol/L AgNO3溶液中加入50mL 0.02mol/L的盐酸生成沉淀。已知Ksp( AgCl)=1.8× 10-10,则生成沉淀后溶液中的c(Ag+)...