本试题 “下列反应中没有涉及到断碳氧键的是( ) A.乙醇的消去 B.乙酸的酯化 C.乙醛的还原 D.苯酚的溴代” 主要考查您对乙醇
苯酚
乙醛
乙酸
化学科学探究
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 乙醇
- 苯酚
- 乙醛
- 乙酸
- 化学科学探究
乙醇分子的组成与结构:
乙醇分子可以看成是乙烷分子中的一个氢原子被羟基(一OH)取代而形成的。乙醇分子的组成与结构见下表: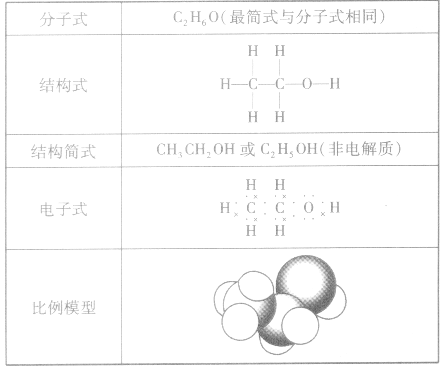
乙醇的性质:
(1)物理性质:俗称酒精,它在常温、常压下是一种易燃、易挥发的无色透明液体,它的水溶液具有特殊的、令人愉快的香味,并略带刺激性。
(2)乙醇的化学性质:
①乙醇可以与金属钠反应,产生氢气,但不如水与金属钠反应剧烈。
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
活泼金属(钾、钙、钠、镁、铝)可以将乙醇羟基里的氢取代出来。
②乙醇的氧化反应:
2CH3CH2OH+O2→2CH3CHO+2H2O(条件是在催化剂Cu或Ag的作用下加热)
③乙醇燃烧:发出淡蓝色火焰,生成二氧化碳和水(蒸气),并放出大量的热,不完全燃烧时还生成一氧化碳,有黄色火焰,放出热量
完全燃烧:C2H5OH+3O2 2CO2+3H2O
2CO2+3H2O
④乙醇可以和卤化氢发生取代反应,生成卤代烃和水。
C2H5OH+HBr→C2H5Br+H2O
注意:通常用溴化钠和硫酸的混合物与乙醇加热进行该反应。故常有红棕色气体产生。
⑤乙醇可以在浓硫酸和高温的催化发生脱水反应,随着温度的不同生成物也不同。
A. 消去(分子内脱水)制乙烯(170℃浓硫酸) C2H5OH→CH2=CH2↑+H2O (消去反应)
B. 缩合(分子间脱水)制乙醚(140℃ 浓硫酸) 2C2H5OH→C2H5OC2H5+H2O(取代反应)
有关醇类的反应规律:
1.消去反应的规律
总是消去和羟基所在碳原子相邻的碳原子上的氢原子,没有相邻的碳原子(如CH3OH)或相邻的碳原子上没有氢原子(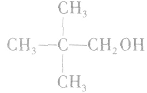 )就不能发生消去反应。能发生消去反应的醇的结构特点为:
)就不能发生消去反应。能发生消去反应的醇的结构特点为:
2.催化氧化反应的规律:
与羟基相连的碳原子上若有2个或3个氢原子,羟基则易被氧化为醛;若有1个氢原子,羟基则易被氧化为酮;若没有氢原子,则羟基一般不能被氧化。即
3.酯化反应的规律
醇与羧酸或无机含氧酸发生酯化反应,一般规律是“酸去羟基醇去氢”即酸脱去一OH,醇脱去一H。
例如: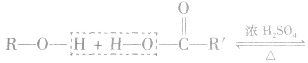

可用氧的同位素: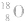 作为示踪原子来确定反应机理。如:
作为示踪原子来确定反应机理。如: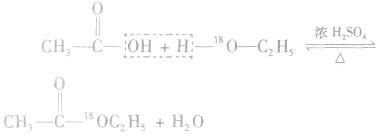
乙醇的工业制法:
(1)乙烯水化法:
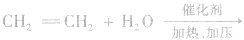
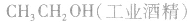
(2)发酵法:

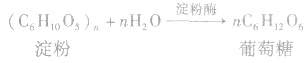
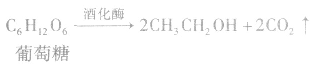
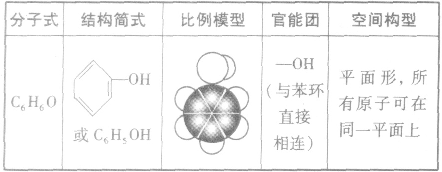
苯酚的结构:
苯酚的性质:
1.物理性质纯净的苯酚是无色的晶体,露置在空气里会因被氧化而呈粉红色。苯酚具有特殊的气味,熔点为43℃。室温时,在水中的溶解度不大,当温度高于65℃时,则能与水以任意比互溶。苯酚易溶于乙醇、乙醚等有机溶剂,有毒,它的浓溶液对皮肤有强烈的腐蚀性。
2.苯酚的化学性质
苯酚的分子结构中既有苯环,又有羟基,它们相互影响。苯酚具有酸性,能与溴水、浓硝酸等发生取代反应,也能与氢气发生加成反应,苯酚还能与FeCl3溶液发生显色反应(显紫色)。
(1)苯酚的弱酸性
实验步骤:取苯酚浊液加氢氧化钠溶液,会变澄清。将得到的澄清液放人两支试管中,分别加入盐酸和通入二氧化碳气体。
实验现象:澄清液加入盐酸和通入二氧化碳气体后又会变浑浊。
实验结论:苯环对羟基的影响结果是使羟基的活性增强,在水溶液中能电离出H+。
反应方程式: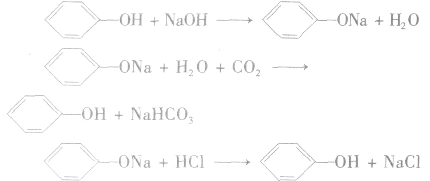
注意:苯酚具有酸性,但是苯酚的酸性极弱,它不能使酸碱指示剂显色,它与碳酸的电离程度的大小为: 因此,苯酚在与碳酸钠溶液反应时,只能生成碳酸氢钠和苯酚钠,而不能生成水和CO2。
因此,苯酚在与碳酸钠溶液反应时,只能生成碳酸氢钠和苯酚钠,而不能生成水和CO2。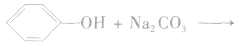
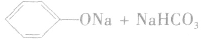
由于苯酚的酸性很弱,因此苯酚钠在水溶液中水解而使溶液显碱性:
相同浓度时,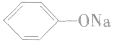 溶液的碱性比
溶液的碱性比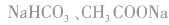 溶液的碱性强。
溶液的碱性强。
(2)苯环上的取代反应
①卤代反应
实验步骤:向少量稀苯酚中加入饱和溴水,观察实验现象。
实验现象:有白色沉淀生成。
实验结论:由于羟基对苯环的影响,使苯环上与羟基处在邻位和对位上的氢原子活性增强,容易被取代。
反应方程式: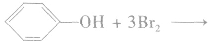
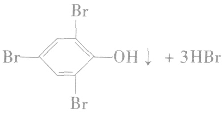
苯酚与溴的反应很灵敏,可用于苯酚的定性检验和定量测定。
注意:2,4,6一三溴苯酚不溶于水,但易溶于苯,若苯中溶有少量苯酚,加浓溴水不会产生白色沉淀,因而用溴水检验不出溶于苯中的苯酚,也不能用溴水来除去苯中混有的少量苯酚(应加NaOH溶液后分液)。
②硝化反应
苯需用混酸进行硝化,而苯酚很容易硝化,与浓硝酸反应即可生成三硝基苯酚。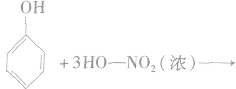
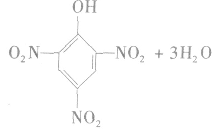
反应生成的2,4,6一三硝基苯酚,俗称苦味酸,可以用作炸药。
(3)苯酚的显色反应苯酚跟FeCl3溶液作用显示紫色,利用这一反应可以检验苯酚的存在。 
(4)氧化反应苯酚晶体在常温下易被空气中的氧气氧化,它也易燃烧,易被酸性KMnO4溶液氧化。
(5)加成反应
苯酚可在苯环上发生加成反应。如:

(6)苯酚与甲醛的缩聚反应
苯酚和甲醛在酸或碱的催化作用下发生反应生成酚醛树脂,反应方程式为: 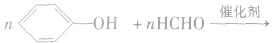
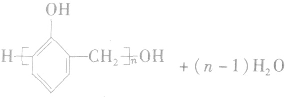
4.苯酚的主要用途
苯酚是一种重要的化工原料,广泛用于制造酚醛树脂、染料、医药、农药等。炼焦工业的废水中常含有酚类物质,这些物质是被控制的水污染物之一,在排放前必须经过处理。
苯酚有毒,但其稀溶液可直接用作防腐剂和消毒剂。
乙醛分子结构: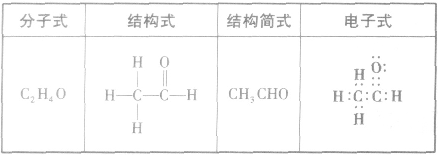
乙醛的性质:
1、物理性质
乙醛是无色、有刺激性气味的液体,密度小于水,沸点为20.8℃。乙醛易挥发,易燃烧,能与水、乙醇、氯仿等互溶。冈为乙醛易挥发,易燃烧,故在使用纯净的乙醛或高浓度的乙醛溶液时要注意防火。
3.化学性质
乙醛分子中的醛基(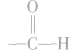 )对乙醛的主要化学性质起决定作用。
)对乙醛的主要化学性质起决定作用。
(1)加成反应
乙醛分子中醛基上的碳氧双键与碳碳双键相似,能够发生加成反应。如使乙醛蒸气和氢气的混合气体通过热的催化剂,乙醛与氢气即发生加成反应:
说明:a.乙醛的催化加氢反应也是还原反应。
b.常见的能发生加成反应的官能团(或基团)有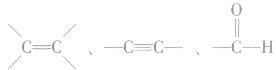 等,但它们发生加成反应的条件不同。
等,但它们发生加成反应的条件不同。
c.由乙醇的催化氧化反应和乙醛的催化加氢反应可知,乙醇和乙醛可在一定条件下相互转化: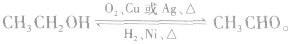
(2)氧化反应
①与银氨溶液的反应——银镜反应
Ag(NH3)2OH(氢氧化二氨合银)是一种弱氧化剂,能把乙醛氧化成乙酸,乙酸又与氨反应生成乙酸铵,而Ag+被还原成金属银附着在试管壁上,形成银镜,所以,这个反应叫做银镜反应。银镜反应常用来检验醛基的存在。工业上可利用这一反应原理,把银均匀地镀在玻璃上制成镜子或保温瓶胆(生产上常用含有醛基的葡萄糖作为还原剂)。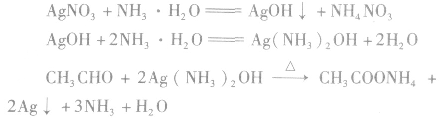
注意a.实验所用试管(玻璃)要洁净。
b.银氨溶液要新配制的,配制银氨溶液是向 AgNO3稀溶液中逐滴加入稀氨水,直到最初生成的沉淀恰好溶解为止。要防止氨水过量,并且必须随配随用,不可久置,否则会生成容易爆炸的物质。
c.实验条件是水浴加热,不能直接加热煮沸。
②与新制氢氧化铜的反应在试管里加入10%的NaOH溶液2mL,滴入2%的CuSO4溶液4~6滴,得到新制的氢氧化铜,振荡后加入乙醛溶液0.5mL,加热煮沸。观察并记录实验现象。
实验现象:生成红色沉淀。
实验结论:在加热的条件下,乙醛能与新制的氢氧化铜发生化学反应。
乙醛与新制的氢氧化铜反应的实验中,涉及的主要化学反应是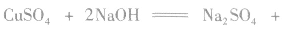
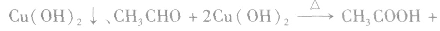
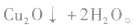 反应中新制的氢氧化铜将乙醛氧化为乙酸,它本身被还原为氧化亚铜(Cu2O)。Cu2O是红色固体,不溶于水,也不与乙酸反应。
反应中新制的氢氧化铜将乙醛氧化为乙酸,它本身被还原为氧化亚铜(Cu2O)。Cu2O是红色固体,不溶于水,也不与乙酸反应。
乙醛与新制的氢氧化铜的反应原理,可用于在实验室里检验醛基的存在,在医疗上检验尿糖。
说明:a.制备新制的Cu(OH)2是在NaOH溶液中滴加少量CuSO4溶液,应保持碱过量;
b.反应条件必须是加热到沸腾。
③与氧气的反应乙醛如在一定温度和催化剂存在的条件下,也能被空气中的氧气氧化成乙酸:
在点燃的条件下,乙醛能在空气或氧气中燃烧。 乙醛完全燃烧的化学方程式为: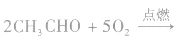
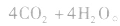
注意a.在工业上,可以利用乙醛的催化氧化反应制取乙酸。
b.银氨溶液、新制氢氧化铜的氧化性很弱,乙醛能被这样的弱氧化剂氧化,原因是乙醛的还原性很强。由此推理,乙醛也易被酸性高锰酸钾溶液、溴水等氧化,高锰酸钾、溴被还原而使溶液褪色。
乙酸分子的组成与结构:
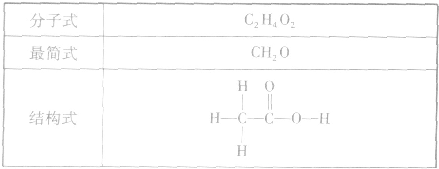
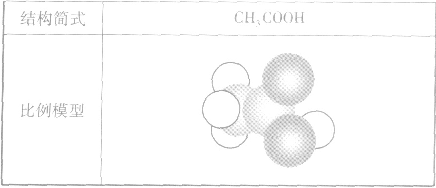
酸从结构上可以看成是甲基和羧基(-COOH)相连而成的化合物。乙酸的官能团是一COOH。
乙酸的性质:
俗称醋酸,具有强烈刺激性气味的无色液体。沸点117.9℃,熔点16.6℃。温度低于熔点时,乙酸凝结成类似冰一样的晶体,纯净的乙酸称为冰醋酸。乙酸溶于水和乙醇。
(1)乙酸的酸性:乙酸的酸性促使它还可以与碳酸钠、氢氧化铜、苯酚钠等物质反应。
2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O
2CH3COOH+Cu(OH)2=Cu(CH3COO)2+2H2O
CH3COOH+C6H5ONa=C6H5OH(苯酚)+CH3COONa
(2)乙酸与金属反应:
2Na+2CH3COOH→2CH3COONa+H2↑
(3)乙酸的酯化反应:
在浓硫酸作用下乙酸和乙醇反应酯化反应
CH3COOH+CH3CH2OH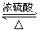 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
四个环节:查阅资料、提出假设、实验探究、结论分析
提出问题→猜想假设→制定计划→进行实验→收集证据→解释与结论→反思与评价 →表达与交流
与“下列反应中没有涉及到断碳氧键的是( ) A.乙醇的消去 B.乙...”考查相似的试题有:
- 有关下列常见有机物的说法中不正确的是( )A.乙醇和乙酸都可以与钠反应生成氢气B.苯、乙醇、乙酸都能发生取代反应C.甲苯和...
- 能证明乙醇分子中含有一个羟基的事实是[ ]A.乙醇完全燃烧生成水B.0.1 mol乙醇与足量金属钠反应生成0.05 mol H2C.乙醇能与...
- 乙醇分子中各化学键如图所示,工业上可用乙烯水化法制得乙醇,下列对乙烯和乙醇的有关说法中不正确的是( )A.乙烯分子为平...
- 乙醇分子结构式如图所示,下列反应及断键部位不正确的是( ) A.乙醇与钠的反应是①键断裂 B.乙醇的催化氧化反应是②③键断裂 ...
- 某有机物的结构简式为,下列关于该有机物的叙述不正确的是( )A.能与金属钠发生反应并放出氢气B.能在催化剂作用下与H2发生...
- 16 g 某一元醇与足量的金属钠完全反应,在标准状况下得到5.6 L氢气,该物质可能是A.CH3OHB.C2H5OHC.C3H7OHD.C4H9OH
- 据下图判断,下列说法不正确的是A.(C6H10O5)n可表示淀粉或纤维素B.反应②化学方程式为C6H12O62C2H5OH+2CO2↑C.反应③得到的乙...
- 分子式为C2H6O的化合物A具有如下性质:(1)根据上述信息,对该化合物可作出的判断是 。A.一定含有—OHB.一定含有—COOHC.A...
- 下列叙述不正确的是( )A.用熟苹果催熟青香蕉B.用四氯化碳作灭火剂C.苯酚皂溶液可用于环境消毒D.日常生活中无水乙醇常用...
- (1)在下列有机物中:①②③CH3CH2CH2CH3④属于烷烃的是(填序号,下同)______,与②互为同系物的是______,与③互为同分异构体的...