本试题 “已知2H2(g)+ O2(g)===2H2O(l) ΔH = -571.6 kJ· mol-1CO(g) + 1/2O2(g) == CO2(g) △H = -283 kJ·mol-1某H2和CO的混合气体完全燃烧时放出113.74 kJ热...” 主要考查您对化学反应热的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应热的计算
应用盖斯定律进行计算的方法:
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
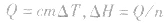
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
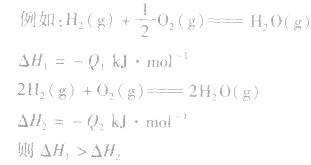
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即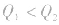 .
.
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
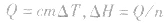
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
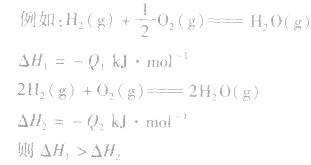
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即
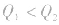 .
. 发现相似题
与“已知2H2(g)+ O2(g)===2H2O(l) ΔH = -571.6 kJ· mol-1C...”考查相似的试题有:
- 化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6...
- NA为阿伏加德罗常数,且已知C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)△H=-1300kJ•mol-1,则下列说法正确的是( )A.当有20NA...
- 随着环保意识的增强,清洁能源越来越受人们关注。(1)甲烷是一种洁净能源,已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802.3 kJ/...
- 化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量。已知白磷和P4O...
- 已知反应 CH4(g) + 2O2(g) == 2H2O(l) + CO2(g);△H = - Q1KJ·mol-12H2(g) + O2(g) == 2H2O(g);△H = -Q2KJ·mol-12H2(g) + O2...
- 质量为8.00 g的某气体,含有3.01×1023个分子,其分子是由碳和氢两种元素的原子构成,实验测得1 mol该气体完全燃烧生成液态水...
- 在36 g碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ/mol;CO(g)+1/2O2(g)...
- 在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4m...
- 已知拆开1mol H-H键,1mol N三N键分别需要吸收的能量为436kJ,946kJ;形成1mol N-H键,会放出能量391kJ,在反应N2+3H22NH3中...
- 下表是某些物质的燃烧热数据:(1)由上表可知: ①分别完全燃烧C(s)和C3H8(g)提供相同的热量时,________产生的温室气体较多。②...