本试题 “请解释下列应对潮湿天气的办法.(1)用生石灰吸潮,其原理用化学方程式表示为______.(2)用木炭除霉味,这是利用了木炭的______性.(3)将油涂在铁艺家具...” 主要考查您对化学反应方程式的书写
文字表达式
金属的锈蚀与防护
生石灰的性质和用途
碳的性质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应方程式的书写
- 文字表达式
- 金属的锈蚀与防护
- 生石灰的性质和用途
- 碳的性质
化学方程式的书写原则遵循两个原则:
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。
化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3 CaO+ CO2↑
CaO+ CO2↑
(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2 CO2
CO2
(3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2 2CuO
2CuO
④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2
 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。 化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
| 常见错误 | 违背规律 |
| 写错物质的化学式 | 客观事实 |
| 臆造生成物或事实上不存在的化学反应 | |
| 写错或漏泄反应条件 | |
| 化学方程式没有配平 | 质量守恒 |
| 漏标多标“↑”、“↓”符号 | —— |
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4
 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。 ③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3
 CaO+ CO2↑
CaO+ CO2↑(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2
 CO2
CO2 (3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2
 2CuO
2CuO ④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
概念:用文字表示化学反应的式子
文字表达式的书写步骤:
(1)写:根据反应事实写出反应物和生成物
(2)注:注明反应条件:[点燃,加热,光照,通电等]
文字表达式的书写步骤:
(1)写:根据反应事实写出反应物和生成物
(2)注:注明反应条件:[点燃,加热,光照,通电等]
金属锈蚀:
金属材料受周围介质的作用而损坏,称为金属腐蚀。金属的锈蚀是最常见的腐蚀形态。腐蚀时,在金属的界面上发生了化学或电化学多相反应,使金属转入氧化(离子)状态。这会显著降低金属材料的强度、塑性、韧性等力学性能,破坏金属构件的几何形状,增加零件间的磨损,恶化电学和光学等物理性能,缩短设备的使用寿命,甚至造成火灾、爆炸等灾难性事故。
铁生锈条件的探究
易错点:
①探究铁生锈的条件时采用经煮沸后迅速冷却的蒸馏水,目的是赶走水中溶解的氧气;再加上植物油用来隔绝空气。
②环境中的某些物质会加快铁的锈蚀,如与酸、食盐溶液等接触的铁制品比钢铁生锈更快。
③铁生锈的过程。实际上是铁与空气中的氧气、水蒸气等发生化学反应的过程(缓慢氧化)。反应过程相当复杂,最终生成物铁锈是一种混合物。铁锈(主要成分是Fe2O3·H2O)为红色,疏松多孔,不能阻碍内层的铁继续与氧气、水等反应,因此铁制品可以全部锈蚀。
④许多金属都易生“锈”,但“锈”的结构不同,成分不同。铜在潮湿的空气中也能生“锈”,铜锈即铜绿,其主要成分为碱式碳酸铜[Cu2(OH)2CO3],是铜与水、氧气、二氧化碳共同作用的产物。
金属制品的防锈原理及方法:
(1)防锈原理根据铁的锈蚀条件不难推断出防止铁生锈的方法是使铁制品隔绝空气或隔绝水。
(2)防锈方法:
①保持铁制品表面洁净和干燥,如菜刀不用时擦干放置。
②在钢铁表面覆盖保护膜、如车、船表而涂油漆。
③在钢铁表而镀一层其他金属,如水龙头表面镀铬、镀锌。
④用化学方法使钢铁表面形成致密的保护膜,如烤蓝。
⑤改善金属的结构,如将钢铁制成不锈钢
(3)除锈方法
物理方法:用砂纸打磨,用刀刮。
化学方法:用酸清洗(酸不能过量),发生的反应为:Fe2O3+6HCl==2FeCl3+3H2O或Fe2O3+3H2SO4==Fe2(SO4)3+3H2O。
金属材料受周围介质的作用而损坏,称为金属腐蚀。金属的锈蚀是最常见的腐蚀形态。腐蚀时,在金属的界面上发生了化学或电化学多相反应,使金属转入氧化(离子)状态。这会显著降低金属材料的强度、塑性、韧性等力学性能,破坏金属构件的几何形状,增加零件间的磨损,恶化电学和光学等物理性能,缩短设备的使用寿命,甚至造成火灾、爆炸等灾难性事故。
铁生锈条件的探究
| 实验装置 | 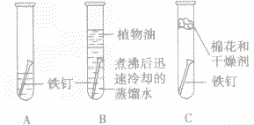 |
| 实验现象 | 几天后观察A试管中铁钉生锈,在水面附近锈蚀 严重,B,C试管中的铁钉没有生锈 |
| 实验分析 | A试管中的铁钉同时跟水、空气(或氧气)接触而生锈; B试管中的铁钉只与水接触不生锈; C 试管中的铁钉只与干燥的空气(或氧气)接触不生锈 |
| 实验结论 | 铁生锈的条件是与水、空气(或氧气)同时接触 |
易错点:
①探究铁生锈的条件时采用经煮沸后迅速冷却的蒸馏水,目的是赶走水中溶解的氧气;再加上植物油用来隔绝空气。
②环境中的某些物质会加快铁的锈蚀,如与酸、食盐溶液等接触的铁制品比钢铁生锈更快。
③铁生锈的过程。实际上是铁与空气中的氧气、水蒸气等发生化学反应的过程(缓慢氧化)。反应过程相当复杂,最终生成物铁锈是一种混合物。铁锈(主要成分是Fe2O3·H2O)为红色,疏松多孔,不能阻碍内层的铁继续与氧气、水等反应,因此铁制品可以全部锈蚀。
④许多金属都易生“锈”,但“锈”的结构不同,成分不同。铜在潮湿的空气中也能生“锈”,铜锈即铜绿,其主要成分为碱式碳酸铜[Cu2(OH)2CO3],是铜与水、氧气、二氧化碳共同作用的产物。
金属制品的防锈原理及方法:
(1)防锈原理根据铁的锈蚀条件不难推断出防止铁生锈的方法是使铁制品隔绝空气或隔绝水。
(2)防锈方法:
①保持铁制品表面洁净和干燥,如菜刀不用时擦干放置。
②在钢铁表面覆盖保护膜、如车、船表而涂油漆。
③在钢铁表而镀一层其他金属,如水龙头表面镀铬、镀锌。
④用化学方法使钢铁表面形成致密的保护膜,如烤蓝。
⑤改善金属的结构,如将钢铁制成不锈钢
(3)除锈方法
物理方法:用砂纸打磨,用刀刮。
化学方法:用酸清洗(酸不能过量),发生的反应为:Fe2O3+6HCl==2FeCl3+3H2O或Fe2O3+3H2SO4==Fe2(SO4)3+3H2O。
生石灰:
凡是以碳酸钙为主要成分的天然岩石,如石灰岩、白垩、白云质石灰岩等,都可用来生产石灰。 主要成分:氧化钙(CaO)。
物理性质:
一般呈块状,纯的为白色,含有杂质时为淡灰色或淡黄色。
化学性质:
在空气中吸收水和二氧化碳。氧化钙与水作用生成氢氧化钙,并放出热量。化学反应方程式为:CaO+H2O==Ca(OH)2
产品用途
1.可作填充剂,例如:用作环氧胶黏剂的填充剂;
2.用作分析试剂,气体分析时用作二氧化碳吸收剂,光谱分析试剂,高纯试剂用于半导体生产中的外延、扩散工序,实验室氨气的干燥及醇类脱l水等;
3.用作原料,可制造电石、纯碱、漂白粉等,也用于制革、废水净化,氢氧化钙及各种钙化合物;
4.可用作建筑材料、冶金助熔剂,水泥速凝剂,荧光粉的助熔剂。
5.用作植物油脱色剂,药物载体,土壤改良剂和钙肥;
6.还可用于耐火材料、干燥剂;
7.可配制农机1、2号胶和水下环氧胶黏剂,还用作与2402树脂预反应的反应剂;
8.用于酸性废水处理及污泥调质;
9.还可用作锅炉停用保护剂,利用石灰的吸湿能力,使锅炉水汽系统的金属表面保持干燥,防止腐蚀,适用于低压、中压、小容量汽包锅炉的长期停用保护;
注意事项:
1、使用操作过程时间越短越好,放置在包装容器内的适当处,起到密封吸湿的作用。
2、存放在干燥库房中,防潮,避免与酸类物接触。
3、运输过程中避免受潮,小心轻放,以防止包装破损而影响产品质量。
4、禁止食用,万一入口,用水漱口立即求医。(切记不能饮水,生石灰是碱性氧化物遇水会腐蚀!)
与熟石灰,石灰乳的区别:
1. 与熟石灰
①石灰有生石灰和熟石灰之分。生石灰的主要成分是氧化钙(CaO),白色固体耐火难溶。将(CaO)含量高的石灰岩在通风的石灰窑中锻烧至900℃以上即得。是有吸水性,可用作干燥剂,我国民间常用以防止杂物回潮。与水反应(同时放出大量的热),或吸收潮湿空气中的水分,即成熟石灰[氢氧化钙Ca(OH)2,又称“消石灰”。熟石灰在一升水中溶解1.56克(20℃),它的饱和溶液称为“石灰水”,呈碱性,在空气中吸收二氧化碳而成碳酸钙沉淀。
②与熟石灰的转化与硬化
生石灰(CaO)与水反应生成氢氧化钙的过程,称为石灰的熟化或消化。反应生成的产物氢氧化钙称为熟石灰或消石灰。
石灰熟化时放出大量的热,体积增大1—2.0倍。煅烧良好、氧化钙含量高的石灰熟化较快,放热量和体积增大也较多。工地上熟化石灰常用两种方法:消石灰浆法和消石灰粉法。
生石灰熟化后形成的石灰浆中,石灰粒子形成氢氧化钙胶体结构,颗粒极细(粒径约为1μm),比表面积很大(达10~30m2/g),其表面吸附一层较厚的水膜,可吸附大量的水,因而有较强保持水分的能力,即保水性好。将它掺入水泥砂浆中,配成混合砂浆,可显著提高砂浆的和易性。
石灰依靠干燥结晶以及碳化作用而硬化,由于空气中的二氧化碳含量低,且碳化后形成的碳酸钙硬壳阻止二氧化碳向内部渗透,也妨碍水分向外蒸发,因而硬化缓慢,硬化后的强度也不高,1:3的石灰砂浆28d的抗压强度只有0.2~0.5MPa。在处于潮湿环境时,石灰中的水分不蒸发,二氧化碳也无法渗入,硬化将停止;加上氢氧化钙微溶于水,已硬化的石灰遇水还会溶解溃散。因此,石灰不宜在长期潮湿和受水浸泡的环境中使用。
石灰在硬化过程中,要蒸发掉大量的水分,引起体积显著收缩,易出现干缩裂缝。所以,石灰不宜单独使用,一般要掺人砂、纸筋、麻刀等材料,以减少收缩,增加抗拉强度,并能节约石灰。 石灰具有较强的碱性,在常温下,能与玻璃态的活性氧化硅或活性氧化铝反应,生成有水硬性的产物,产生胶结。因此,石灰还是建筑材料工业中重要的原材料。
2. 与石灰乳
石灰乳一般是在氧化钙中加水生成的,因为氢氧化钙溶解度不是很大,所以往往生成的是氢氧化钙的悬浊液(即水溶液中还存在着没有溶解的氢氧化钙),这就是石灰乳
石灰乳是石灰浆用水稀释后的混浊液。 指石灰加入过量的水(约为石灰质量的2.5-3倍)后得到的浆体。
凡是以碳酸钙为主要成分的天然岩石,如石灰岩、白垩、白云质石灰岩等,都可用来生产石灰。 主要成分:氧化钙(CaO)。
物理性质:
一般呈块状,纯的为白色,含有杂质时为淡灰色或淡黄色。
化学性质:
在空气中吸收水和二氧化碳。氧化钙与水作用生成氢氧化钙,并放出热量。化学反应方程式为:CaO+H2O==Ca(OH)2
产品用途
1.可作填充剂,例如:用作环氧胶黏剂的填充剂;
2.用作分析试剂,气体分析时用作二氧化碳吸收剂,光谱分析试剂,高纯试剂用于半导体生产中的外延、扩散工序,实验室氨气的干燥及醇类脱l水等;
3.用作原料,可制造电石、纯碱、漂白粉等,也用于制革、废水净化,氢氧化钙及各种钙化合物;
4.可用作建筑材料、冶金助熔剂,水泥速凝剂,荧光粉的助熔剂。
5.用作植物油脱色剂,药物载体,土壤改良剂和钙肥;
6.还可用于耐火材料、干燥剂;
7.可配制农机1、2号胶和水下环氧胶黏剂,还用作与2402树脂预反应的反应剂;
8.用于酸性废水处理及污泥调质;
9.还可用作锅炉停用保护剂,利用石灰的吸湿能力,使锅炉水汽系统的金属表面保持干燥,防止腐蚀,适用于低压、中压、小容量汽包锅炉的长期停用保护;
注意事项:
1、使用操作过程时间越短越好,放置在包装容器内的适当处,起到密封吸湿的作用。
2、存放在干燥库房中,防潮,避免与酸类物接触。
3、运输过程中避免受潮,小心轻放,以防止包装破损而影响产品质量。
4、禁止食用,万一入口,用水漱口立即求医。(切记不能饮水,生石灰是碱性氧化物遇水会腐蚀!)
与熟石灰,石灰乳的区别:
1. 与熟石灰
①石灰有生石灰和熟石灰之分。生石灰的主要成分是氧化钙(CaO),白色固体耐火难溶。将(CaO)含量高的石灰岩在通风的石灰窑中锻烧至900℃以上即得。是有吸水性,可用作干燥剂,我国民间常用以防止杂物回潮。与水反应(同时放出大量的热),或吸收潮湿空气中的水分,即成熟石灰[氢氧化钙Ca(OH)2,又称“消石灰”。熟石灰在一升水中溶解1.56克(20℃),它的饱和溶液称为“石灰水”,呈碱性,在空气中吸收二氧化碳而成碳酸钙沉淀。
②与熟石灰的转化与硬化
生石灰(CaO)与水反应生成氢氧化钙的过程,称为石灰的熟化或消化。反应生成的产物氢氧化钙称为熟石灰或消石灰。
石灰熟化时放出大量的热,体积增大1—2.0倍。煅烧良好、氧化钙含量高的石灰熟化较快,放热量和体积增大也较多。工地上熟化石灰常用两种方法:消石灰浆法和消石灰粉法。
生石灰熟化后形成的石灰浆中,石灰粒子形成氢氧化钙胶体结构,颗粒极细(粒径约为1μm),比表面积很大(达10~30m2/g),其表面吸附一层较厚的水膜,可吸附大量的水,因而有较强保持水分的能力,即保水性好。将它掺入水泥砂浆中,配成混合砂浆,可显著提高砂浆的和易性。
石灰依靠干燥结晶以及碳化作用而硬化,由于空气中的二氧化碳含量低,且碳化后形成的碳酸钙硬壳阻止二氧化碳向内部渗透,也妨碍水分向外蒸发,因而硬化缓慢,硬化后的强度也不高,1:3的石灰砂浆28d的抗压强度只有0.2~0.5MPa。在处于潮湿环境时,石灰中的水分不蒸发,二氧化碳也无法渗入,硬化将停止;加上氢氧化钙微溶于水,已硬化的石灰遇水还会溶解溃散。因此,石灰不宜在长期潮湿和受水浸泡的环境中使用。
石灰在硬化过程中,要蒸发掉大量的水分,引起体积显著收缩,易出现干缩裂缝。所以,石灰不宜单独使用,一般要掺人砂、纸筋、麻刀等材料,以减少收缩,增加抗拉强度,并能节约石灰。 石灰具有较强的碱性,在常温下,能与玻璃态的活性氧化硅或活性氧化铝反应,生成有水硬性的产物,产生胶结。因此,石灰还是建筑材料工业中重要的原材料。
2. 与石灰乳
石灰乳一般是在氧化钙中加水生成的,因为氢氧化钙溶解度不是很大,所以往往生成的是氢氧化钙的悬浊液(即水溶液中还存在着没有溶解的氢氧化钙),这就是石灰乳
石灰乳是石灰浆用水稀释后的混浊液。 指石灰加入过量的水(约为石灰质量的2.5-3倍)后得到的浆体。
概述:
碳是一种非金属元素,位于元素周期表的第二周期IVA族。拉丁语为Carbonium,意为“煤,木炭”。汉字“碳”字由木炭的“炭”字加石字旁构成,从“炭”字音。碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳之中。碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。碳是生铁、熟铁和钢的成分之一。碳能在化学上自我结合而形成大量化合物,在生物上和商业上是重要的分子。生物体内大多数分子都含有碳元素。
碳的存在形式:
碳的存在形式是多种多样的,有晶态单质碳如金刚石、石墨;有无定形碳如煤;有复杂的有机化合物如动植物等;碳酸盐如大理石等。单质碳的物理和化学性质取决于它的晶体结构。高硬度的金刚石和柔软滑腻的石墨晶体结构不同,各有各的外观、密度、熔点等。
碳的化学性质:
1.稳定性:在常温下碳的化学性质稳定,点燃或高温的条件下能发生化学反应
2.可燃性:
氧气充足的条件下:C+O2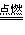 CO2
CO2
氧气不充分的条件下:2C+O2 2CO
2CO
3.还原性:
木炭还原氧化铜:C+2CuO 2Cu+CO2↑
2Cu+CO2↑
焦炭还原氧化铁:3C+2Fe2O3 4Fe+3CO2↑
4Fe+3CO2↑
焦炭还原四氧化三铁:2C+Fe3O4 3Fe+2CO2↑
3Fe+2CO2↑
木炭与二氧化碳的反应:C+CO2 CO
CO
碳”与“炭”的区别:
“碳”是一种核电荷数为6的非金属元素,而“炭” 一般是指由石墨的微小晶体和少量杂质组成的混合物,如木炭、焦炭、活性炭、炭黑等。在说明碳元素时,用“碳”表示,如碳单质、二氧化碳、碳酸等;在说明含石墨的无定形碳时,用“炭”表示,如木炭、焦炭等。
碳燃烧生成物的判断:
氧气量充足时,碳充分燃烧:C+O2 CO2
CO2
氧气量不充足时,碳不充分燃烧:2C+O2 2CO
2CO
mg碳与ng氧气反应:
①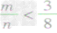 时,生成物只有CO,且O2有剩余;
时,生成物只有CO,且O2有剩余;
②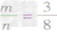 时,恰好完全反应生成CO2;
时,恰好完全反应生成CO2;
③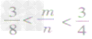 时,生成物既有CO2,也有CO;
时,生成物既有CO2,也有CO;
④ 时,恰好完全反应生成CO;
时,恰好完全反应生成CO;
⑤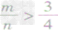 时,生成物只有CO,且C有剩余。
时,生成物只有CO,且C有剩余。
碳单质及其化合物间的转化:
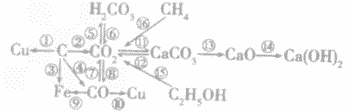
(1)C+2CuO 2Cu+CO2↑
2Cu+CO2↑
(2)C+O2 CO2
CO2
(3)3C+2Fe2O3 4Fe+3CO2↑
4Fe+3CO2↑
(4)2C+O2 2CO
2CO
(5)CO2 + H2O===H2CO3
(6)H2CO3==CO2 + H2O
(7)2CO + O2 2CO2
2CO2
(8)C+CO2 2CO
2CO
(9)3CO + Fe2O3 2Fe + 3CO2
2Fe + 3CO2
(10)CO+ 2CuO 2Cu + CO2
2Cu + CO2
(11)Ca(OH)2 + CO2====CaCO3↓+ H2O
(12)CaCO3+2HCl==CaCl2+CO2↑+H2O
(13)CaCO3 CaO+CO2
CaO+CO2
(14)CaO+H2O==Ca(OH)2
(15)C2H5OH+3O2 2CO2+3H2O
2CO2+3H2O
(16)CH4+O2 CO2+2H2O
CO2+2H2O
碳是一种非金属元素,位于元素周期表的第二周期IVA族。拉丁语为Carbonium,意为“煤,木炭”。汉字“碳”字由木炭的“炭”字加石字旁构成,从“炭”字音。碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳之中。碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。碳是生铁、熟铁和钢的成分之一。碳能在化学上自我结合而形成大量化合物,在生物上和商业上是重要的分子。生物体内大多数分子都含有碳元素。
碳的存在形式:
碳的存在形式是多种多样的,有晶态单质碳如金刚石、石墨;有无定形碳如煤;有复杂的有机化合物如动植物等;碳酸盐如大理石等。单质碳的物理和化学性质取决于它的晶体结构。高硬度的金刚石和柔软滑腻的石墨晶体结构不同,各有各的外观、密度、熔点等。
碳的化学性质:
1.稳定性:在常温下碳的化学性质稳定,点燃或高温的条件下能发生化学反应
2.可燃性:
氧气充足的条件下:C+O2
 CO2
CO2 氧气不充分的条件下:2C+O2
 2CO
2CO 3.还原性:
木炭还原氧化铜:C+2CuO
 2Cu+CO2↑
2Cu+CO2↑ 焦炭还原氧化铁:3C+2Fe2O3
 4Fe+3CO2↑
4Fe+3CO2↑ 焦炭还原四氧化三铁:2C+Fe3O4
 3Fe+2CO2↑
3Fe+2CO2↑ 木炭与二氧化碳的反应:C+CO2
 CO
CO 碳”与“炭”的区别:
“碳”是一种核电荷数为6的非金属元素,而“炭” 一般是指由石墨的微小晶体和少量杂质组成的混合物,如木炭、焦炭、活性炭、炭黑等。在说明碳元素时,用“碳”表示,如碳单质、二氧化碳、碳酸等;在说明含石墨的无定形碳时,用“炭”表示,如木炭、焦炭等。
碳燃烧生成物的判断:
氧气量充足时,碳充分燃烧:C+O2
 CO2
CO2 氧气量不充足时,碳不充分燃烧:2C+O2
 2CO
2CO mg碳与ng氧气反应:
①
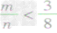 时,生成物只有CO,且O2有剩余;
时,生成物只有CO,且O2有剩余;②
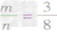 时,恰好完全反应生成CO2;
时,恰好完全反应生成CO2; ③
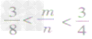 时,生成物既有CO2,也有CO;
时,生成物既有CO2,也有CO;④
 时,恰好完全反应生成CO;
时,恰好完全反应生成CO; ⑤
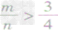 时,生成物只有CO,且C有剩余。
时,生成物只有CO,且C有剩余。 碳单质及其化合物间的转化:

(1)C+2CuO
 2Cu+CO2↑
2Cu+CO2↑ (2)C+O2
 CO2
CO2(3)3C+2Fe2O3
 4Fe+3CO2↑
4Fe+3CO2↑ (4)2C+O2
 2CO
2CO (5)CO2 + H2O===H2CO3
(6)H2CO3==CO2 + H2O
(7)2CO + O2
 2CO2
2CO2 (8)C+CO2
 2CO
2CO(9)3CO + Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 (10)CO+ 2CuO
 2Cu + CO2
2Cu + CO2 (11)Ca(OH)2 + CO2====CaCO3↓+ H2O
(12)CaCO3+2HCl==CaCl2+CO2↑+H2O
(13)CaCO3
 CaO+CO2
CaO+CO2 (14)CaO+H2O==Ca(OH)2
(15)C2H5OH+3O2
 2CO2+3H2O
2CO2+3H2O(16)CH4+O2
 CO2+2H2O
CO2+2H2O 发现相似题
与“请解释下列应对潮湿天气的办法.(1)用生石灰吸潮,其原理用...”考查相似的试题有:
- 用适当的数字或符号填空⑴2个铝原子__________ ⑵氯化钠中的阴离子 ⑶1个铵根离子________ ⑷氧化铜中+2价的铜元素____ ⑸保持水的...
- 2008年9月搭载着“神舟七号“飞船的“长征2号F“型运载火箭顺利升空,航天员翟志刚进行了我国首次太空行走,飞船顺利回归,这是我...
- 下列反应属于置换反应的是( )A.CH4+2O2CO2+2H2OB.Fe2O3+3CO2Fe+3CO2C.CuSO4+2NaOH=Cu(OH)2↓+Na2SO4D.C+2CuO2Cu+CO2↑
- 有甲、乙、丙、丁、戊、己等六种常见物质,它们的关系如下图所示,图中“—”表示相连的物质两两之间可发生反应,“→” 表示由某一...
- 高铁酸钾(K2FeO4)是一种新型高效水处理剂。高铁酸钾(K2FeO4)中铁元素的化合价为A.+3B.+4C.+2D.+6
- 下列化学方程式符合题意且书写正确的是( )A.镁带在空气中燃烧:Mg+O2=MgO2B.检验二氧化碳的存在:CO2+NaOH=Na2CO3+H2OC....
- 物质在“潮湿的空气”中发生的变化,与空气中某些气体有关.下列说法错误的是( )A.钢铁生锈与氧气、水蒸气有关B.生石灰堆放...
- 化学与我们的生活息息相关,它不仅为人类生活创造了丰厚的物质基础,而且为人类社会可持续发展作出了巨大贡献.(1)请从A盐...
- “黑块块,烧就红,投入室瓶仙气中,金光耀眼银光闪,无影无踪瓶中空;一杯钙泉入宝瓶,化作牛奶无人用.”以上描述的实验现象...
- 善于梳理化学知识,能使你的头脑更聪明.以下知识的梳理完全正确的一组是( ) A性质与用途 B安全常识氢气有可燃性--冶炼金属...