本试题 “在一定条件下,CO和CH4燃烧的热化学方程式分别为2CO(g)+O2(g)=2CO2(g); △H=-566kJ/molCH4(g)+2O2(g)=CO2(g)+2H2O(1);△H=-890kJ/mol...” 主要考查您对盖斯定律
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 盖斯定律
盖斯定律的内容:
不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如: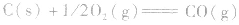 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
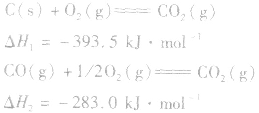
根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知
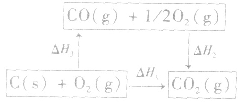
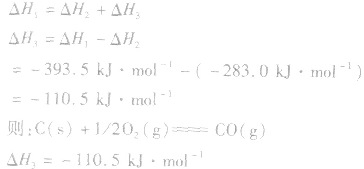
盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时
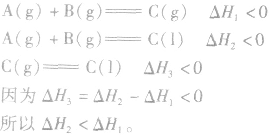
若按以下思路分析:
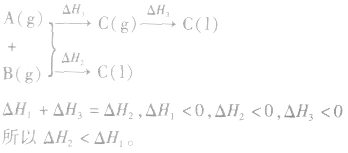
2.同一反应物状态不同时
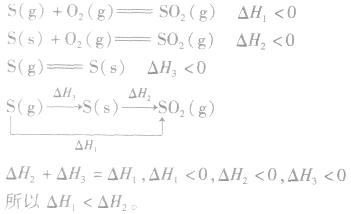
3.两个有联系的不同反应相比
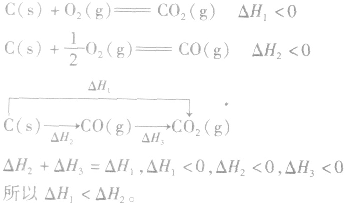
并且据此可写出下面的热化学方程式:

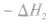
不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如:
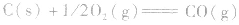 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。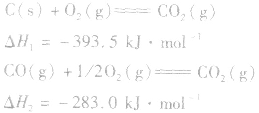
根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知
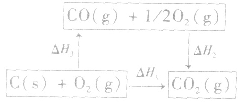
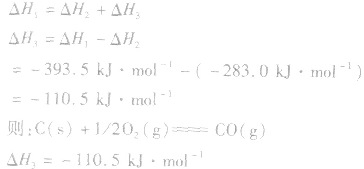
盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时
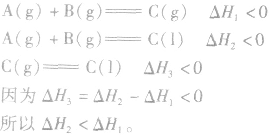
若按以下思路分析:
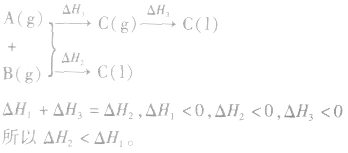
2.同一反应物状态不同时
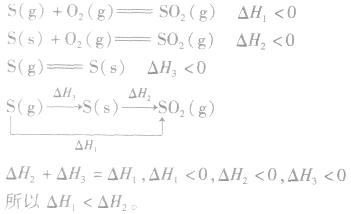
3.两个有联系的不同反应相比
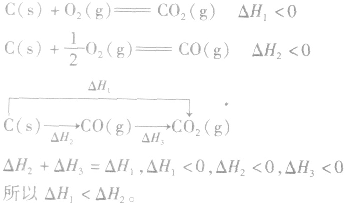
并且据此可写出下面的热化学方程式:

发现相似题
与“在一定条件下,CO和CH4燃烧的热化学方程式分别为2CO(g)+O2...”考查相似的试题有:
- 钛(Ti)被称为继铁、铝之后的第三金属。由金红石(TiO2) 制取单质Ti,涉及的步骤为:TiO2→TiCl4已知:①C(s)+O2(g)=CO2(g) △H=-3...
- 已知:2CO(g)+O2(g)==2CO2(g) ΔH=-566 kJ/mol Na2O2(s)+CO2(g)==Na2CO3(s)+1/2O2(g) ΔH=-226kJ/mol 根据以上热化学方...
- 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g) = CO2(g)+3H2(g);△H = + 49.0 kJ/mol②CH...
- (Ⅰ)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大.W、Y的氧化物是导致酸雨的主要物质,X的基态原子...
- 已知25 ℃、101 kPa下,下列反应C(石墨) + O2(g) === CO2(g) ,燃烧1 mol C(石墨)放热393.51 kJ。C(金刚石) + O2(g) === CO2(g...
- 在36 g 碳不完全燃烧所得气体中,CO占体积1/3,CO2占体积2/3,且C(s) + 1/2O2(g) = CO(g) △H = -110.5 kJ/molCO(g) + 1/2O2(...
- 合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为:N2(g)+3H2(g)3...
- I.把煤作为燃料可通过下列两种途径:途径ⅠC(s)+O2(g)═CO2(g);△H1<0①途径Ⅱ先制成水煤气:C(s)+H2O(g)═CO(g)+H2...
- 下列说法正确的是[ ]A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同B.甲烷燃烧热的热化学方程式CH4(g) + ...
- 已知蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表H2Br2HBr1mol分子中的化学键断裂需要吸收的能量/kJ436a369则...