本试题 “A、B、C三元素原子的核外电子数都比氩原子少,A和C处于同主族,两者间隔一周期,A元素和B元素的原子两者核电荷数之差为5,B原子核外第3电子层比第2电子层少两...” 主要考查您对原子结构示意图
元素周期表
离子结构示意图
共价化合物
离子化合物
电子式的书写
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 原子结构示意图
- 元素周期表
- 离子结构示意图
- 共价化合物
- 离子化合物
- 电子式的书写
定义:
圆圈和圆圈内的数字分别表示原子核和核内的质子数,弧线表示电子层,弧线上的数字表示该层的电子数。
表示原子结构的常用图示:
1.原子符号:
2.核外电子分层排布示意图:
3.原子结构示意图:
相对原子质量及近似相对原子质量:
1.几个概念的辨析
| 原子的真实质量 | 原子的真实质量也称绝对质量,是通过精密的实验测得的,原子的真实质量很小,使用极不方便,所以科学上,一般不直接使用原子的真实质量,而使用原子的相对质量—— 相对原子质量 |
| 核素的相对原子质量 | 核素的相对原子质量是指一个核素原子的质量与一个碳-12原子质量的l/12的比值 |
| 元素的相对原子质量 | 元素的相对原子质量是指某元素各种核素的相对原子质量与各核素原子所占的原子个数百分比(丰度)的乘积之和,也就是元素周期表中所给的相对原子质量的数值。一般情况下元素的相对原子质量不为整数 |
| 原子的质量数 | 原子的质量数是指某元素的一种核素原子的核中所含质子数和中子数之和,在实际使用中常代替相对原子质量,所以也叫做近似相对原子质量。需要注意的是元素无质量数 |
2.近似相对原子质量
1.核素的近似相对原子质量,就是核素的质量数。
2.元素的近似相对原子质量,就是按照该元素各种核素的质量数和各种核素原子所占的原子个数百分比算出的平均值。例如,氯元素的近似相对原子质量为:
元素周期表编排原则:
(1)把电子层数相同的各种元素按原子序数递增的顺序从左至右排成横行。
(2)把最外层电子数相同的元素按电子层数递增的顺序由上到下排列成纵行。
注意:①元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律。
②历史上第一个元素周期表是1869年俄国化学家门捷列夫在前人探索的基础上排成的,他将元素按相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行。
元素周期表的结构:
(1)周期
①周期的含义在元素周期表中,把电子层数相同的元素,按原子序数递增的顺序从左到右排成横行,这样每个横行为一个周期。现在使用的元素周期表有7个横行,即7 个周期。
②周期的划分
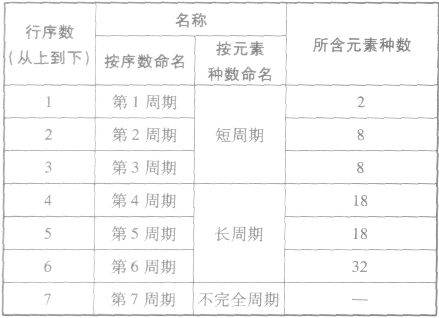
(2)族
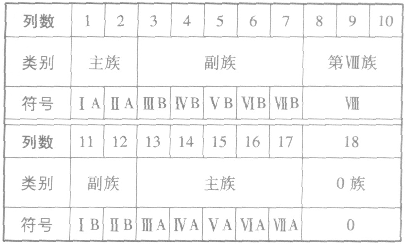
①族的含义在周期表中,把不同横行(即周期)中最外层电子数相同的元素,按电子层数递增的顺序由上到下排成纵行,除第8、9、10三个纵行叫做第Ⅷ族外,其余15个纵行,每个纵行为一族。现在使用的元素周期表有18 个纵行,它们被划分为16个族。
②族的划分
(3)元素周期表中主族元素金属性和非金属性的递变
正离子的离子结构示意图中核内质子数大于核外电子数;
负离子的离子结构示意图中核内质子数小于核外电子数。
原子是否满足最外层8电子结构的判断方法:
1.离子化合物
(1)阳离子:看“主族元素原子的次外层电子数+ 原子的最外层电子数一化合价数”是否等于8,若为8,则该原子满足最外层8电子结构,否则不满足。
(2)阴离子:看“其原子的最外层电子数+化合价的绝对值”是否等于8,若为8,则该原子满足最外层8 电子结构,否则不满足。
2.共价化合物计算“各原子的最外层电子数+化合价的绝对值” 是否等于8,若为8,则该原子满足最外层8电子结构,否则不满足。另外,还有一些不满足8电子结构的特殊粒子,请大家记住:
(1)主族元素形成的化合物中:
a.H、Li、Be、B元素原子不满足最外层8电子结构.
b.非最高价离子(如 Pb2+、Bi3+等)也不满足最外层8电子结构。
(2)过渡金属元素形成的离子最外层电子数一般大于8.
直接相邻原子间均以共价键相结合的化合物。共价化合物中只含共价键。
离子化合物和共价化合物的比较:

含有离子键的化合物称为离子化合物,离子化合物中肯定存在离子键,也可以存在共价键。
定义:
在化学反应中,一般是原子的最外层电子数目发生变化。为了简便起见,化学中常在元素符号周围用小黑点“· ”或小叉“×”来表示元素原子的最外层电子,相应的式子叫做电子式。
(1)原子的电子式:H· 、Na· 、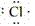
(2)阳离子的电子式:不画出离子最外层电子数,元素右上角标出“n+”电荷字样:Na+、Al3+、Mg2+
(3)阴离子的电子式:要画出最外层电子数,用 “[ ]”括起来,右上角标出“n-”: 、
、 、
、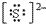
(4)离子化合物的电子式:由阴、阳离子的电子式组成,相同离子不能合并: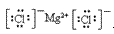 、
、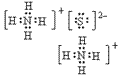
(5)共价化合物的电子式:画出离子最外层电子数: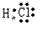 、
、
(6)用电子式表示物质形成的过程:
氯化氢的形成过程: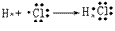
氯化镁的形成过程: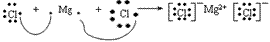
结构式:
共价键中的每一对共用电子用一根短线表示,未成键电子不写出,物质的电子式就变成了结构式。
例如: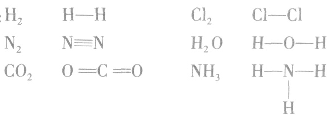
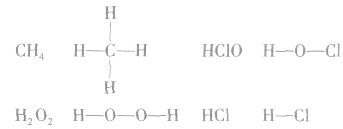
书写电子式的常见错误:
1.漏写未参与成键的电子,如: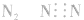
2.化合物类型不清,漏写或多写“[]”及错写电荷数,如: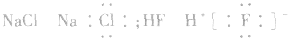
3.书写不规范,错写共用电子对如:N2的电子式为: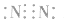 ,不能写成:
,不能写成: ,更不能写成:
,更不能写成: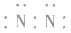 或
或 。
。
4.不考虑原子间的结合顺序如:HClO的电子式为 ,而非
,而非 。因氧原子需形成2对共用电子才能达到稳定结构,而H、 Cl各需形成1对共用电子就能达到稳定结构。
。因氧原子需形成2对共用电子才能达到稳定结构,而H、 Cl各需形成1对共用电子就能达到稳定结构。
5.不考虑原子最外层有几个电子均写成8电子结构如: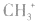 的电子式为
的电子式为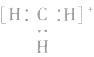 ,而非
,而非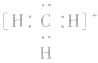 , 因
, 因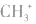 中碳原子最外层应有6个电子(包括共用电子),而非8个电子。
中碳原子最外层应有6个电子(包括共用电子),而非8个电子。
6.不清楚A如型离子化合物中两个B是分开写还是写一块如: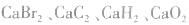 中
中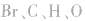 均为-l 价,Br-、H-已达到稳定结构,应分开写;C原子得一个电子,最外层有5个电子,需形成三对共用电子才能达到稳定结构,不能分开写;氧原子得一个电子,最外层有7个电子,需形成一对共用电子才能达到稳定结构,也不能分开写。它们的电子式分别为:
均为-l 价,Br-、H-已达到稳定结构,应分开写;C原子得一个电子,最外层有5个电子,需形成三对共用电子才能达到稳定结构,不能分开写;氧原子得一个电子,最外层有7个电子,需形成一对共用电子才能达到稳定结构,也不能分开写。它们的电子式分别为: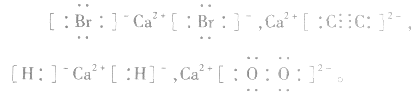
与“A、B、C三元素原子的核外电子数都比氩原子少,A和C处于同主族...”考查相似的试题有:
- 下表是元素周期表的一部分,针对表中的指定元素,用元素符号或化学式填空回答以下问题(1)金属性最强的元素是____________,...
- 根据元素在周期表中的位置,判断下列各组化合物的水溶液的酸、碱性的强弱.(填<或>)(1)、H3PO4______HNO3(2)、KOH___...
- A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,C的非金属性最强,A、D同主族 隔周期,E元素原子最外层的p亚层...
- 下列叙述中,金属A的活泼性肯定比金属B的活泼性强的是( )A.1molA从酸中置换H+生成的H2比1molB从酸中置换H+生成的H2多B.常...
- 下列各组中的三种元素既可以组成离子化合物,又可以形成共价化合物的是[ ]A.H、N、OB.Na、S、OC.H、O、CD.H、S、O
- 下列叙述正确的是( )A.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物B.原子晶体、离子晶体、金属晶体、分子晶...
- 下列有关化学用语能一定确定为丙烯的是[ ]A.B.C.D.
- 下表是元素周期表的一部分,回答下列问题:(1)写出①---⑿号元素的元素符号①___ ②___ ③____ ④____ ⑤____ ⑥____ ⑦___ ⑧____ ⑨_...
- 下列化学用语中,正确的是[ ]A.丙烷的分子式:C3H8B.硫离子结构示意图:C.苯的结构简式:D.氯化钠的电子式
- 下列化学用语正确的是[ ]A .I-131:7853IB.Cl的结构示意图:C.H2S的电子式:D.Fe3+的电子排布图:1s22s22p63s23p63d5