本试题 “25℃和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+ O2(g) △H=+56.76kJ/mol,自发进行的原因是[ ]A.是吸热反应B.是放热反应C.是熵减少的反应D.熵增大效...” 主要考查您对化学反应进行的方向
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应进行的方向
化学反应的方向与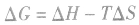 :
:
1.化学反应进行方向的判据
(1)由稳定性弱的物质向稳定性强的物质转变
如 ,稳定性
,稳定性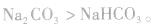
(2)离子反应总是向着使反应体系中某些离子浓度减小的方向进行
①溶解度大的物质向溶解度小的物质转变,如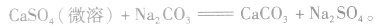
②由相对强酸(碱)向相对弱酸(碱)转变,如 ,
,  所以酸性强弱:
所以酸性强弱: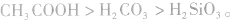
(3)由难挥发性物质向易挥发性物质转变
如 所以沸点:
所以沸点: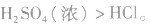
(4)由氧化性(还原性)强的物质向氧化性(还原性)弱的物质转变
如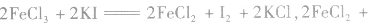
 ,则氧化性:
,则氧化性: 。
。
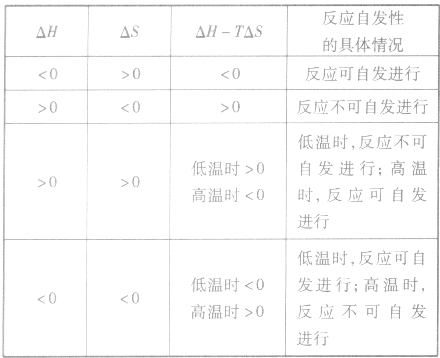
2.焓变和熵变共同判断反应的方向:
在温度、压强一定的条件下,自发反应总是向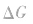
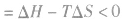 的方向进行,直至达到平衡状态;
的方向进行,直至达到平衡状态;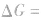
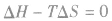 表明反应已达到平衡状态;
表明反应已达到平衡状态;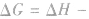
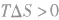 表明反应不能自发进行。
表明反应不能自发进行。
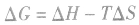 :
:1.化学反应进行方向的判据
(1)由稳定性弱的物质向稳定性强的物质转变
如
 ,稳定性
,稳定性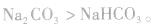
(2)离子反应总是向着使反应体系中某些离子浓度减小的方向进行
①溶解度大的物质向溶解度小的物质转变,如
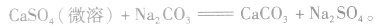
②由相对强酸(碱)向相对弱酸(碱)转变,如
 ,
,  所以酸性强弱:
所以酸性强弱: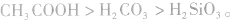
(3)由难挥发性物质向易挥发性物质转变
如
 所以沸点:
所以沸点: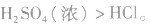
(4)由氧化性(还原性)强的物质向氧化性(还原性)弱的物质转变
如
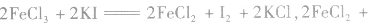
 ,则氧化性:
,则氧化性: 。
。 2.焓变和熵变共同判断反应的方向:
在温度、压强一定的条件下,自发反应总是向
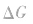
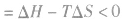 的方向进行,直至达到平衡状态;
的方向进行,直至达到平衡状态;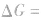
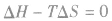 表明反应已达到平衡状态;
表明反应已达到平衡状态;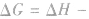
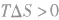 表明反应不能自发进行。
表明反应不能自发进行。
发现相似题
与“25℃和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+ O2(g) △H=...”考查相似的试题有:
- 关于熵值(S)的叙述不正确的是( )A.熵值是一个物理量,只与物质的种类有关,而与其它因素无关B.同一种物质,其所处的状...
- 下列说法正确的是[ ]A.常温下,向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则常温下...
- 对于化学反应进行方向的确定,下列说法中正确的是 ( )A.温度、压强一定时,放热且熵减小的反应一定能自发进行B.温度、压强...
- 在一定量的密闭容器中进行反应:N2(g)+3H2(g)⇌2NH3(g).已知反应过程中某一时刻N2、H2、NH3浓度分别为0.1mol/L、0.3mol...
- 对于可逆反应A(g)+B(g)2C(g)+D(g)—Q当达到平衡后,在其他条件不变时,若增大压强。以下说法正确的是 A.正反应速度增...
- 现有反应:mA(g) + nB(g)pC(g),达到平衡后,当升高温度时, B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:...
- 下列各项不正确的是A.等物质的量浓度的下列溶液中① NH4Al(SO4)2② NH4Cl,③CH3COONH4,④ NH3·H2O; c(NH4+),由大到小的顺序...
- 自发进行的反应一定是[ ]A.吸热反应B.放热反应C.熵增加反应D.熵增加或者放热反应
- 某化学课外小组为了探究CaCl2溶液和Na2SO4溶液反应有没有限度,设计了如下活动过程,请完成表中空格:(已知CaSO4在水中微溶...
- 下列反应一定能自发进行的是[ ]A.放热反应B.熵增加的反应C.熵增加的放热反应D.熵增加的吸热反应