本试题 “下列物质的熔沸点高低顺序正确的是[ ]A.金刚石>晶体硅>二氧化硅>碳化硅B.Cl4>CBr4>CCl4>CH4C.MgO>H2O>O2>N2D.金刚石>生铁>纯铁>钠” 主要考查您对原子晶体
离子晶体
分子晶体
金属晶体
合金
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 原子晶体
- 离子晶体
- 分子晶体
- 金属晶体
- 合金
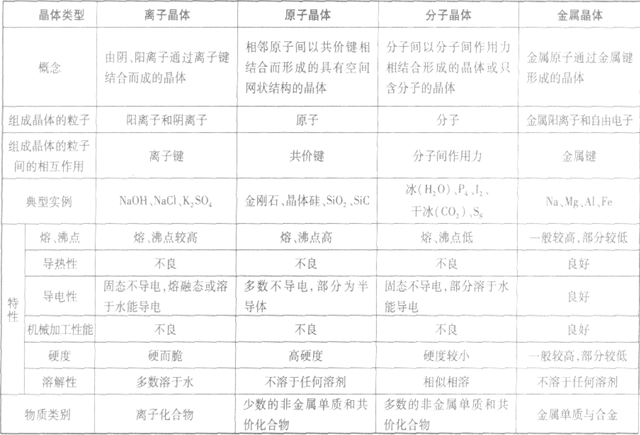
相邻原子间以共价键相结合而形成空间网状结构的晶体,熔沸点高,导热性、延展性不良,导电性差,硬度大。如:金刚石、石英。
晶体的基本类型与性质:
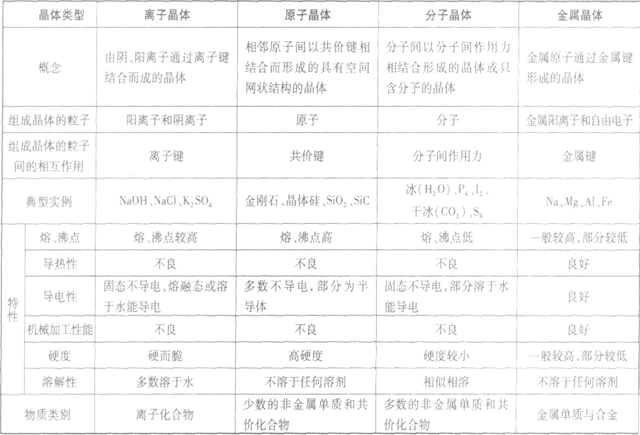
晶体熔、沸点高低的比较规律:
(1)不同类型晶体的熔、沸点高低规律:一般,原子晶体>离子晶体>分子晶体。金属晶体的熔、沸点有的很高,如钨、铂等;有的则很低,如汞、铯等。
(2)同种类型晶体,晶体内粒子间的作用力越大,熔、沸点越高。
①分子晶体:分子间作用力越大,物质的熔、沸点越高,反之越低。
a.组成和结构相似的分子,相对分子质量越大,范德华力越大,熔、沸点越高。如沸点:O2>N2、HI>HBI>HCl(含氢键的除外)。
b.相对分子质量相等或相近的分子,极性分子的范德华力大,熔、沸点高。如沸点:CO>N2。
c.含有氢键的分子熔、沸点比较高。如沸点:H2O >H2Te>H2Se>H2S,HF>HCl,NH3>PH3。
d.在烷烃的同分异构体中,一般来说,支链越多,熔、沸点越低。如沸点:正戊烷>异戊烷>新戊烷。芳香烃及其衍生物苯环上的同分异构体熔、沸点大小一般按照“邻位>问位>对位”的顺序。
e.在高级脂肪酸形成的油脂中,油的熔、沸点比脂肪低,烃基部分的不饱和程度越大(碳碳双键越多),熔、沸点越低,如:
(C17H35COO)3C3H5>(C17H33COO)3C3H5
硬脂酸甘油酯 油酸甘油酯
②原子晶体:要比较共价键的强弱。一般来说,原子半径越小,键长越短,键能越大,共价键越牢固,晶体的熔、沸点越高.如熔点:金刚石(C—C)>金刚砂 (Si—C)>晶体硅(Si—Si)>锗(Ge—Ge)。
③离子晶体:要比较离子键的强弱。一般来说,阴、阳离子电荷数越多,离子半径越小,离子键越强,熔、沸点越高,如熔点:MgO>NaCl,KF>KCl>KBr> KI。离子晶体的晶格能越大,其熔、沸点越高。
④金属晶体:要比较金属键的强弱。金属晶体中金属原子的价电子数越多,原子半径越小,金属阳离子与自由电子间的静电作用越强,金属键越强,熔、沸点越高,反之越低,如熔点:Na<Mg<Al。
(3)元素周期表中ⅦA族卤素的单质(分子晶体) 的熔、沸点随原子序数递增而升高;笫IA族碱金属元素的单质(金属晶体)的熔、沸点随原子序数的递增而降低。如熔、沸点:Li>Na>K>Rb>Cs。
注意:上述总结的是一般规律,不能绝对化。在具体比较晶体的熔、沸点高低时,应先弄清晶体的类型,然后根据不同类型晶体进行判断,但应注意具体问题具体分析。如MgO为离子晶体,[大]为离子半径小且离子电荷多,离子键较强,其熔点(2852℃)要高于部分原子晶体,如SiO2(1710℃)。
离子间通过离子间结合而形成的晶体,熔点较高、沸点高,导热性、延展性不良,固态不导电、熔融或溶于水导电,脆而硬,如:NaCl
晶体的基本类型与性质:

晶体类型的判断方法:
1.依据晶体的组成微粒与微粒间作用力来判断
离子晶体的组成微粒是阴、阳离子,微粒间作用力是离子键;原子晶体的组成微粒是原子,微粒间作用力是共价键;分子晶体的组成微粒是分子,微粒间作用力是分子间作刚力;金属晶体的组成微粒是金属阳离子和自南电子,微粒间作用力是金属键。
2.依据物质的分类判断
金属氧化物(如K2O、Na2O等)、强碱(如NaOH、 KOH等)和绝大多数的盐是离子晶体。大多数非金属单质(除金刚石、石墨、品体硅、晶体硼以外)、气态氢化物、非金属氧化物(除SiO2以外)、酸、绝大多数有机物 (除有机盐以外)都是分子晶体。常见的属于原子晶体的单质有金刚石、晶体硅、晶体硼、晶体锗等,常见的属于啄子品体的化合物有碳化硅(SiC)、氮化硅(Si3N4)、氮化硼(BN)、二氧化硅(SiO2)等。金属单质与合金是金属晶体.
3.依据晶体的熔点判断
离子晶体熔点较高,常在几百至一千摄氏度。原子晶体熔点高,常在一千至几千摄氏度。分子晶体熔点低,常在几百摄氏度以下至很低的温度。金属晶体的熔点范围最广,钨的熔点比部分原子晶体还要高,汞的熔点比部分分子晶体还要低。
4.依据导电性判断离子晶体水溶液及熔化时能导电、原子晶体一般为非导体。分子晶体为非导体,但分子晶体中的电解质溶于水,使分子内的化学键断裂形成自由离子也能导电。金属晶体是电的良导体。
5.依据硬度和机械性能判断
离子晶体硬度大(或硬而脆);分子晶体硬度较小;原子晶体硬度大;金属晶体多数硬度大,但也有较小的,具有延展性。
分子之间通过分子间作用力结合形成的晶体,熔沸点低,导热性、延展性不良,导电性差,硬度较小。如:干冰、固态氖。
晶体的基本类型与性质:

晶体结构模型:
| 晶体 | 晶体结构模型 |
| 氯化铯晶体 |  |
| 氯化钠晶体 | 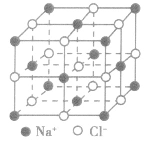 |
| 氟化钙晶体 |  |
| 二氧化碳晶体 | 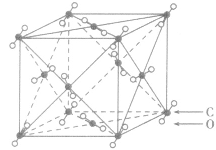 |
| 金刚石晶体 |  |
| SiO2晶体 | 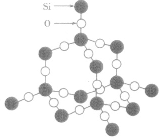 |
| 石墨晶体 (混合晶体) |  |
晶体中的几个不一定:
(1)由非金属元素构成的晶体不一定为分子品体。如NH4Cl。
(2)具有导电性的晶体不一定是金属晶体。如Si、石墨。
(3)离子晶体不一定只含离子键。如NaOH、 FeS2、Na2O2。
(4)由氢化物构成的晶体不一定是分子晶体。如NaH。
(5)金属与非金属元素构成的晶体不一定是离子晶体。如AlCl3为分子晶体。
(6)原子晶体不一定为绝缘体。如Si。
(7)溶于水能导电的晶体不一定是离子晶体。如HCl。
(8)离子晶体的熔点不一定低于原子晶体。如 MgO的熔点为2852℃,而SiO2的熔点为1710℃。
(9)金属晶体的熔点不一定低于原子晶体。如w 的熔点达34lO℃。
(10)金属晶体的熔点不一定高于分子晶体。如 Hg常温下呈液态,而硫、白磷常温下呈同态.
(11)金属晶体的硬度不一定小于原子晶体。如Cr 的硬度为9,仅次于金刚石。
(12)金属晶体的硬度不一定大于分子晶体。如 Na的硬度只有0.4,可用小刀切割。
(13)晶体巾有阳离子不一定有阴离子。如构成金
通过金属离子与自由电子间的较强作用(金属键)形成的单质晶体,熔沸点(除Hg外)高,导热性、延展性良好,易导电,硬度一般较大。
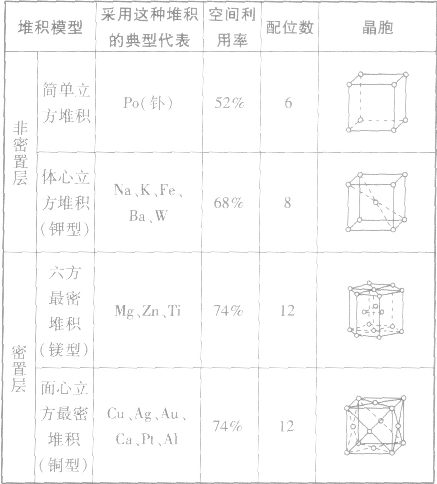
如:金属单质金属晶体原子堆积模型:
(1)简单立方堆积 (2)体心立方堆积 (3)六方最密堆积和面心立方最密堆积
晶体的基本类型与性质:
金属晶体的原子堆积模型:
合金的概念:
由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
合金的特性:
合金与各成分金属相比,具有许多优良的物理、化学和机械性能。
(1)合金的硬度一般比它的成分金属的大。
(2)合金的熔点一般比它的成分金属的低。
钢:
(1)钢和生铁同属于铁的合金。将铁矿石冶炼成生铁,生铁进一步冶炼可成为钢。
(2)钢是用量最大、用途最广的合金,按其化学成分可分为两大类:碳素钢和合金钢。
(3)碳素钢俗称普通钢。根据含碳量的多少,碳素钢又可以分为三类,见下表:
| 合金名称 | 含碳 | 主要性质 |
| 低碳钢 | <0.3% | 韧性、焊接性好,但强度低 |
| 中碳钢 | 0.3%~0.6% | 强度高,韧性及加工性好 |
| 高碳钢 | >0.6% | 硬而脆,热处理后弹性好 |
| 名称 | 其他主要合金元素 | 主要特性 | 主要用途 |
| 锰钢 | 锰 | 韧性好,硬度大 | 钢轨、轴承、钢磨、挖掘机铲斗、坦克装甲 |
| 不锈钢 | 铬、镍 | 抗腐蚀性好 | 医疗器械、容器、炊具等 |
| 硅钢 | 硅 | 导磁性好 | 变压器、发电机和电动机的铁芯 |
| 钨钢 | 钨 | 耐高温,硬度大 | 刀具 |
其他几种常见合金的主要成分,性能和用途:
| 合金 | 主要成分 | 主要性能 | 主要用途 |
| 球墨铸铁 | 铁,碳,硅,锰 | 机械强度好 | 在某些场合可代替钢 |
| 黄铜 | 铜,锌 | 强度高、可塑性 好、易加工、耐腐蚀 |
机器零件、仪表、日用品 |
| 青铜 | 铜,锡 | 强度高、可塑性好、 耐磨、耐腐蚀 |
机器零件如轴承、齿轮等 |
| 白铜 | 镍,铜 | 光泽好、耐磨、 耐腐蚀、易加工 |
钱币、代替银做饰品 |
| 焊锡 | 锡,铅 | 熔点低 | 焊接金属 |
| 硬铝 | 铝,铜,锰,镁,硅 | 强度和硬度好 | 火箭、飞机、轮船等制造业 |
| 钛合金 | 钛,铝,钒 | 耐高温、耐腐蚀、高强度 | 用于宇航、飞机、造船,化学工业 |
| 金合金 | 金,银,铜,稀土元素 | 有光泽、易加工、耐磨、耐腐蚀、易导电 | 金饰品、电子元件、钱币、笔尖 |
| Ti-Fe合金 | Ti,Fe | 室温下吸收H2快,且吸收H2量大,稍稍加热放H2速率快 | 储氢合金 |
合金的分类:
(1)铝合金:常见的有镁铝合金、硬铝等。硬铝密度小,强度高,具有较强的抗腐蚀能力,是制造飞机和字宙飞船的理想材料。
(2)铜合金
(3)
(4)新型合金:钛合金、耐热合金和形状记忆合金等。
几种有色金属材料的比较及新型金属材料:
1.金,银,铜的重要物理性质,性能及应用比较
| 金 | 银 | 铜 | ||
| 物理性质 | 颜色 | 黄色 | 银白色 | 紫红色 |
| 硬度 | Au<Ag<Cu | |||
| 延展性 | Au>Ag>Cu | |||
| 导电性 | Ag>Cu>Au | |||
| 导热性 | Ag>Cu>Au | |||
| 性能 | 极高的抗腐蚀性 | 催化,抗腐蚀性 | 在潮湿空气中易锈蚀 | |
| 应用 | 电子工业,航空,航天工业 | 有机合成,能源开发,医用材料制造 | 电气和电子工业,建筑材料 | |
2.新型金属材料
(1)铀(U)用作核电站反应堆的核燃抖
(2)镅(Am)在烟雾探测器中用作烟雾监测材料
(3)钛(Ti)被誉为“21世纪的金属”,是一种“亲生物金属”
金属资源的合理开发和利用:
1.合理开采矿物地球上的金属矿产资源是有限的,而且是不可再生的。随着人类不断地开发利用,矿产资源日渐减少,节约并合理地开采矿产资源是合理利用金属资源最直接,最基本水的措施
2.防止金属腐蚀金属制品在使用过程中会因腐蚀而损坏,每年因腐蚀造成的钢铁资源损失占当年总产量的10%以上,因此防腐是避免金属资源损失、浪费的重要手段
3.回收和利用废旧金属回收的废旧金属制品,大部分可以重新制成金属或它们的化合物,再进行使用。例如废旧钢铁可以用于炼钢;废铁屑可用于制铁盐
4.寻找金属替代品随着金属资源的目益减少,利用可再生资源开发、研制出新型材料代替金属材料的应用,是当今社会的一项重要科研课题,例如已经研制出并已实际运用的高硬度、耐高温材料;新型的替代钢铁的无机非金属材料料;有机化工合成的各种强度的橡胶、塑料,复合材料等
与“下列物质的熔沸点高低顺序正确的是[ ]A.金刚石>晶体硅>二氧...”考查相似的试题有:
- 在常温常压下呈气态的化合物,降温使其固化得到的晶体属于[ ]A.分子晶体B.原子晶体C.离子晶体D.何种晶体无法判断
- 下列叙述中,错误的是[ ]A.离子化合物中可能含有非极性键B.分子晶体中的分子内不含有离子键C.原子晶体中可能含有非极性键D...
- 下列微粒之间,属于同位素的是 ,属于同素异形体的是 ,属于同分异构体的是 属于同一物质的是 。A.正丁烷与异丁烷B.红磷与...
- 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。(1)下列叙述正确的是______(填字母)。A.CH2O与水分子间能形成氢键...
- 分子晶体在通常情况下不具有的性质是( )A.晶体微粒是分子B.干燥或熔化时均能导电C.晶体内微粒间以范德华力结合D.熔点和...
- 下列有关金属晶体的说法中不正确的是( )A.金属晶体是一种“巨分子”B.“电子气”为所有原子所共有C.简单立方堆积的空间利用率...
- 下列说法不正确的是[ ]A.我国最早使用的合金是由铜锌合金制成的青铜器B.储氢合金是一类能大量吸收H2,并与H2结合成金属氢化...
- 合金是一类用途广泛的金属材料,下列物质中不属于合金的是( ) A.碳素钢 B.不锈钢 C.青铜 D.铜绿
- 下列有关合金的说法不正确的是( )A.多数合金比单一金属有更大的硬度B.多数合金比单一金属有更高的熔点C.我国早在3000年...
- 合金是不同种金属(也包括金属和非金属)在熔化状态下形成的一种具有金属特性的熔合物,下表中难与表中其他金属形成二元合金...