本试题 “pH值为4的FeCl3溶液和pH值为10的K2CO3溶液中,水的电离度分别为α1和α2,则它们的大小关系是( )A.α1>α2B.α1<α2C.α1=α2D.无法判断” 主要考查您对水电离的影响因素
水的电离平衡
盐类水解的定义
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 水电离的影响因素
- 水的电离平衡
- 盐类水解的定义
影响水电离平衡的因素:
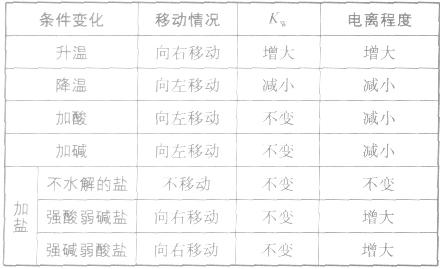
水的电离:
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O
 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L 注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
盐类水解:
1.定义:在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类水解。
2.实质:生成弱电解质,使水的电离平衡被破坏而建立新的平衡。
3.条件:盐中必须有弱酸根离子或弱碱阳离子,盐溶于水。
4.特点:可逆性,写水解离子方程式时要用“ ” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
5.规律:有弱才水解,无弱不水解。谁弱谁水解,谁强显谁性。越弱越水解,都弱都水解。例如:25℃时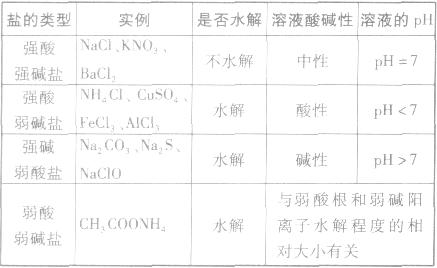
四种重要的动态平衡的比较:
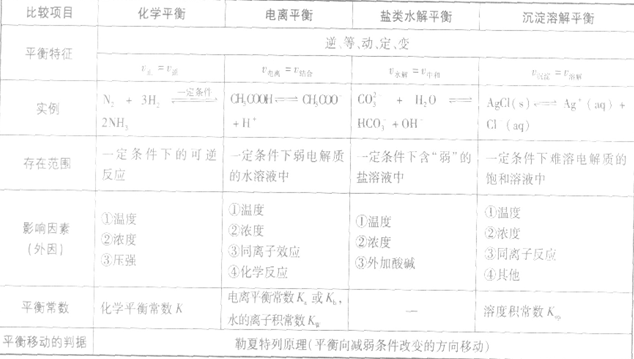
发现相似题
与“pH值为4的FeCl3溶液和pH值为10的K2CO3溶液中,水的电离度分别...”考查相似的试题有:
- (6分)KMnO4溶液与H2C2O4溶液可发生如下反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O(1)该反应速率开始十分缓慢,...
- 常温下,将甲酸与NaOH溶液混合,所得溶液的pH=7,则此溶液中( )A.c(HCOO-)>c(Na+)B.c(HCOO-)<c(Na+)C.c(HC...
- (12分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:① 用蒸馏水洗涤碱式滴定管,并立即注入Na...
- 将0.1 mol·L-1氨水10 mL与0.1 mol·L-1盐酸12 mL 混合后,溶液中各种离子物质的量浓度由大到小的顺序应是( )A.c(Cl-)>c(NH)>c...
- 25℃时的下列五种溶液中,水的电离程度由大到小排列顺序正确的是溶质HCl(aq)FeCl3NaOHHCOONaC2H5OH溶液的pH341011未测定水的电...
- 常温下,用 0.1000 mol·L-1NaOH溶液滴定 20.00mL0.1000 mol·L-1CH3COOH溶液所得滴定曲线如图。下列说法正确的是A.滴定过程中...
- 室温下,在pH=12的强碱溶液中,由水电离出的c(OH-)为( )A.1.0×10-7mol•L-1B.1.0×10-6mol•L-1C.1.0×10-2mol•L-1D.1.0×10...
- 下列说法正确的是①NaHCO3溶液加水稀释,c(Na+)/ c(HCO3-)的比值保持增大②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液...
- 在相同温度下,等体积、等物质的量浓度的四种溶液:①Na2SO4②H2SO3③NaHSO3④Na2S,其中所含带电粒子数由多到少的顺序是()A.④>①...
- 25℃时,几种弱酸的电离常数如下:弱酸的化学式CH3COOHHCNH2S电离常数(25℃)1.8×10-54.9×10-10K1=1.3×10-7K2=7.1×10-1525℃...