本试题 “海水中主要是含氯化钠,此外还含有氯化钙、氯化镁、硫酸盐等。 海水制精盐,经过以下主要流程:(1)填写下列物质的化学式:B、 C、 D、 。(2)在“过滤1”的...” 主要考查您对海水“晒盐”的原理和过程
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 海水“晒盐”的原理和过程
概述:
从海水中提取食盐的方法主要是“盐田法”这是一种古老的而至今仍广泛沿用的方法。使用该法。需要在气候温和,光照充足的地区选择大片平坦的海边滩涂,构建盐田。盐田一般分成两部分:蒸发池和结晶池。先将海水引入蒸发池,经日晒蒸发水分到一定程度时,再倒入结晶池,继续日晒,海水就会成为食盐的饱和溶液,再晒就会逐渐析出食盐来。这是得到的晶体就是我们常见的粗盐。剩余的液体称为母液,可从中提取多重化工原料。
海水→蒸发池→结晶池→粗盐和母液
海水“晒”盐:
1. 原理:海水经日晒、风吹等,使溶剂不断减少,溶质的质量分数逐渐增大,
直至形成饱和溶液,继而析出晶体。
2. 过程:先将海水引入蒸发池,经日晒蒸发水分到一定程度时,再引入结晶池,继续日晒,
海水就会成为食盐的饱和溶液,再晒,就会析出食盐来。
这时,得到的晶体就是我们常见的“粗盐”,剩余的液体称为母液(或“苦卤”)。
示意图如下: 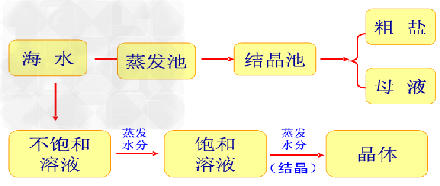
发现相似题
与“海水中主要是含氯化钠,此外还含有氯化钙、氯化镁、硫酸盐等...”考查相似的试题有:
- 粗盐中含有钙离子、硫酸根离子和泥沙等杂质,实验室中粗盐提纯的操作步骤如下:(1)将粗盐研细,加水使其充分溶解,然后过滤...
- 海洋中有丰富的水生生物和化学资源.海水晒盐后,以其母液(卤水)和贝壳为原料,还可生产具有特殊用途的材料﹣﹣纳米氧化镁...
- 如图为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线.(1)当温度为10℃时,碳酸钠的溶解度为______;(2)当温度______时,...
- 请根据溶液的有关知识回答下列问题:(1)将KNO3饱和溶液变成不饱和溶液可采取的措施有 .(2)“海水晒盐”的原理是 .(3)配...
- 我市有江苏最长的海岸线、最大的沿海滩涂、最大的海域面积……“沿海兴,则盐城兴”。某校学生以此为主题展开相关研究。(1)盐城在...
- 学习化学的目的是运用化学知识解释日常生活中的现象,分析和解决生产生活中的实际问题.下列说法中你认为错误的是( )A.敞...
- 海水晒盐的原理是( )A.日晒风吹使氯化钠的溶解度降低B.日晒风吹使溶液由饱和变为不饱和C.日晒风吹使水分蒸发,食盐晶体...
- 下列说法不正确的是( )A.粗盐经过“溶解、过滤、结晶”提纯,得到的是纯净氯化钠B.海水“晒盐”的原理是蒸发溶剂结晶法C.铵...
- 据《说文解字》记载,我们的祖先在神农氏时代就开始利用海水晒盐。海水晒盐的原理是[ ]A.日晒风吹使海水中的氯化钠蒸发B.日...
- 海洋是巨大的资源宝库,从海洋中可提取许多重要物质。请你参与下列问题的讨论:(1)某市一盐场测得:①海水中含NaCl约为3.5%;②...