本试题 “下列推论正确的是( )A.碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐B.酸与碱反应生成盐和水,所以生成盐和水的反应一定是酸与碱...” 主要考查您对爆炸、自燃
盐的性质
酸碱指示剂
中和反应及在实际中的应用
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 爆炸、自燃
- 盐的性质
- 酸碱指示剂
- 中和反应及在实际中的应用
自燃:
1. 概念:自燃是由缓慢氧化引起的自发燃烧。如果缓慢氧化产生的热量不能及时散失,就会越积越多,当温度升高到可燃物的着火点时,如果再遇到氧气就会引起自发的燃烧,这就是自燃。
爆炸:
1. 概念:通常说的爆炸指可燃物拒有限空间内急速燃烧,短时间内聚积大量的热量,使气体体积迅速膨胀引起的爆炸。
自燃:
露在地表的煤层,由于气候炎热,发生缓慢氧化反应而导致自燃。
贮存棉花、饲草的仓库,沾满机器油的破布、棉丝等堆积时间长了,通风不好有时就会自燃。在干燥的季节,森林也会自燃。
在坟地里出现“磷火”也是一种自燃现象。
人和动物机体里含磷的有机物腐败分解能生成磷化氢气体。这种气体着火点很低,接触空气就会自燃。在缺乏科学知识的时代,常把这种自燃现象说成是“鬼火”。
平时将白磷浸泡在冷水里,防止自燃。白磷的着火点低(40℃),可用它做自燃实验。取出少许白磷溶解在二硫化碳中,然后把溶液倒在滤纸上,待二硫化碳挥发后,白磷在滤纸上与空气中氧气充分接触就会自燃。
爆炸:
爆炸是我们日常生活中常见的观象,但有的爆炸仅仅是由物理变化引起的,如轮胎爆炸;有螳爆炸则是由化学变化引起的,如火药爆炸,汽油、液化气等燃料的爆炸等。其中,由化学变化引起的爆炸是学习的重点,这种类型的爆炸主要是由于:
①在有限的空间 (如炸弹)内,发生急速的燃烧,短时问聚积大量的热,使气体的体积迅速膨胀;
②氧气的浓度高,或者可燃物 (气体、粉尘)与氧气的接触面积很大,燃烧范围广,周围的空气迅速猛烈膨胀。防止这类爆炸的方法:通风,禁止烟火等。
燃烧,缓慢氧化,自燃,爆炸(由化学变化引起)的比较:
| 燃烧 | 缓慢氧化 | 自燃 | 爆炸 | |
| 概念 | 可燃物与氧气发生的一种发光放热的剧烈的氧化反应 | 缓慢进行的氧化反应 | 由缓慢氧化引起的自发燃烧 | 可燃物在有限空间内发生的急速燃烧 |
| 能量变化 | 放热明显 | 放出热量随时散失 | 放热明显 | 放热明显 |
| 温度 | 达到可燃物的着火点 | 未达到可燃物的着火点 | 达到可燃物的着火点 | 达到可燃物的着火点 |
| 是否发光 | 发光 | 无明显发光现象 | 发光 | 发光 |
| 联系 | 均属于氧化反应,均放出热量 | |||
易燃易爆物的安全知识:
(1)易燃物:一般来说,易燃物指的是那些易燃的气体和液体,容易燃烧、自燃或遇水可以燃烧的固体,以及一些可以引起其他物质燃烧的物质等。常见的有硫;磷、酒精,液化石油气、氢气、乙炔、沼气、石油产品、面粉、棉絮等。
(2)易爆物:指的是那受热或受到撞击时.容易发生爆炸的物质。
(3)一些与燃烧和爆炸有关的图标:

(4)再生产、运输、使用、储存易燃、易爆物时的注意事项:
①对厂房和仓库的要求:与周围建筑物间有足够的防火距离。车间,仓库要有防火、防爆、通风、静电除尘、消防等器材设备,严禁烟火,杜绝一切可能产生火花的因素。容器要求:要牢固、密封、警示标志明显且要注明物品名称、化学性质、注意事项。
③存放要求:单存、单放、远离火种:注意通风。
④运输要求:轻拿轻放、勿撞击。
⑤工作人员要求:严禁烟火、人走电断。
火灾自救及逃生策略:
(1)可燃性气体泄漏时的注意事项当室内天然气、液化石油气、煤气泄漏后室内充满可燃性气体.在此环境中打电话或打开换气扇开关,可能产生电火花,造成爆炸、所以应先关闭总阀、开窗通风,并在杜绝一切明火的同时,查找泄露的原因。
(2)火灾自救策略
①迅速找到安全通道;
②火灾时上层空气中氧气少,毒气浓度大,所以要匍匐前进:
③房间发生火灾时不能随时开门开窗,开门开窗会增加氧气量,使火势更加凶猛;
④火灾时,会产生大量浓烟,使人窒息,因此最好用湿布捂住口鼻;
⑤在山林中遇到火灾时,应逆风而跑,因为顺着风更容易被烧伤或发生危险。
爆炸极限:
(1)概念:可燃性气体在空气中达到一定浓度时,遇到明火会发生爆炸,人们把容易导致爆炸的空气中可燃性气体的体积分数范围,称为该气体的爆炸极限。
①当可燃性气体在混合气体中的含量高于爆炸极限的上限时,可燃性气体可以安静地燃烧;而低于爆炸极限的下限时,则无法燃烧。
②我们通常所说额可燃性气体检验纯度,其实就是检验可燃性气体有没有达到爆炸极限,只要超过爆炸极限的上限,可燃性气体就可以安静的燃烧。
(2)几种常见物质的爆炸极限
| 可燃物 | 爆炸极限 |
| 甲烷 | 5%-15% |
| 丙烷 | 2.2%-9.5% |
| 乙醇 | 3.4%-19% |
| 氢气 | 4.0%-75% |
| 一氧化碳 | 12.5%-74% |
| 液化气 | 2.0%-12% |
| 水煤气 | 7.0%-72% |
粉尘爆炸实验:
(1)实验装置及步骤
下面是模拟粉尘爆炸的一个实验:如下图所示,在无盖小塑料筒里放入干燥面粉,点燃蜡烛,用塑料盖盖住金属筒,迅速鼓入大量空气,不久,便会听到“砰”的一声,爆炸的气浪将金属筒的塑料盖掀起。
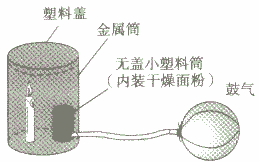
(2)现象:砰的一声响,伴随着一团火光产生,放热,塑料盖被掀起。
(3)分析:面粉被吹起,与空气充分接触,又被蜡烛点燃,在有限空间内发生急剧地燃烧,并让出大量热,产生的气浪将塑料盖掀起,说明可燃物的粉尘在有限的空间内急剧燃烧,能发生爆炸。
盐的定义:
盐是指由金属离子(或钱根离子)和酸根离子构成的化合物,盐在溶液里能解离成金属离子(或钱根离子)和酸根离子。根据阳离子不同,可将盐分为钠盐、钾盐、钙盐、钱盐等,根据阴离子不同,可将盆分为硫酸盐、碳酸盐,硝酸盐等。
生活中常见的盐有:
氯化钠(NaCl),碳酸钠 (Na2CO3)、碳酸氧钠(NaHCO3)、碳酸钙和农业生产上应用的硫酸铜(CuSO4)。
盐的物理性质:
(1)盐的水溶液的颜色常见的盐大多数为白色固体,其水溶液一般为无色。但是有些盐有颜色,其水溶液也有颜色。例如:胆矾(CuSO4·5H2O)为蓝色,高锰酸钾为紫黑色;含Cu2+的溶液一般为蓝色,含Fe2+的溶液一般为浅绿色,含Fe3+的溶液一般为黄色。
(2)盐的溶解性记忆如下钾钠硝钱溶水快(含K+,Na+,NH4+,NO3-的盐易溶于水);硫酸盐除钡银钙(含SO42-的盐中,Ag2SO4, CaSO4微溶,BaSO3难溶)都易溶;氯化物中银不溶(含 Cl-的盐中,AgCl不溶于水,其余一般易溶于水);碳酸盐溶钾钠钱[含CO32-的盐,Na2CO3、(NH4)2CO3、 K2CO3易溶,Na2CO3微溶,其余难溶〕。
盐的化学性质:
(1)盐+金属一另一种盐+另一种金属(置换反应),例如:Fe+CuSO4==FeSO4+Cu
规律:反应物中盐要可溶,金属活动性顺序表中前面的金属可将后面的金属从其盐溶液中置换出来(K, Ca,Na除外)。
应用:判断或验证金属活动性顺序和反应发生的先后顺序。
(2)盐+酸→另一种盐+另一种酸(复分解反应),例如;HCl+AgNO3==AgCl↓+HNO3。
规律:反应物中的酸在初中阶段一般指盐酸、硫酸、硝酸。盐是碳酸盐时可不溶,若是其他盐,则要求可溶。应用:实验室制取CO2,CO32-、Cl-,SO42-的检验。
(3)盐+碱→另一种盐+另一种碱(复分解反应)
规律:反应物都可溶,若反应物中盐不为按盐,生成物其中之一为沉淀或水。
应用:制取某种碱,例如:Ca(OH)2+Na2CO3== CaCO3↓+2NaOH。
(4)盐+盐→另外两种盐
规律:反应物都可溶,生成物至少有一种不溶于水。
应用:检验某种离子或物质。例如:NaCl+AgNO3 =AgCl↓+NaNO3(可用于鉴定Cl-);Na2SO4+BaCl2==BaSO4↓+2NaCl(可用与鉴定SO42-)
几种常见盐的性质及用途比较如下表:
易错点:
①“食盐是盐是对的,但“盐就是食盐”是错误的,化学中的“盐”指的是一类物质。
②石灰石和大理石的主要成分是碳酸钙,它们是混合物,而碳酸钙是纯净物。
③日常生活中还有一种盐叫亚硝酸钠,工业用盐中常含有亚硝酸钠,是一种自色粉末,有咸味,对人体有害,常用作防腐保鲜剂。
④CuSO4是一种白色固体,溶于水后形成蓝色的CuSO4溶液,从CuSO4溶液中结品析出的晶体不是硫酸铜,而是硫酸铜晶休,化学式为CuSO4·5H2O,俗称胆矾或蓝矾,是一种蓝色固体。硫酸铜与水结合也能形成胆矾,颜色由白色变为蓝色.利用这种特性常用硫酸铜固体在化学实验中作检验水的试剂。
盐的命名:
(1)只有两种元素组成的盐,读作“某化某”,如 NaCl读作氯化钠,AgI读作碘化银。
(2)构成中含有酸根的,读作“某酸某”。如Na2CO3、ZnSO4、AgNO3、KMnO4、KClO3分别读作:碳酸钠、硫酸锌、硝酸银、高锰酸钾、氯酸钾。
(3)含铵根的化合物,读作“某化铵”或“某酸铵”。如NH4Cl、(NH4)2SO4读作:氯化铵、硫酸铵。
(4)其他:Cu2(OH)2CO3读作“碱式碳酸铜”, NaHSO4读作“硫酸氢钠”, NaHCO3读作“碳酸氢钠”。
风化:
风化是指结晶水合物在室温和干燥的条件下失去结晶水的现象,这种变化属于化学反应。如 Na2CO3·10H2O==Na2CO3+10H2O;CaSO4·2H2O ==CaSO4+2H2O。
侯氏制碱法:
我国化工专家侯德榜于1938-1940年用了三年时间,成功研制出联合制碱法,后来命名为“侯氏联合制碱法”。其主要原理是:
NH3+CO2+H2O== NH4HCO3
NH4HCO3+NaCl ==NaHCO3↓+NH4CI
2NaHCO3==Na2CO3+H2O+CO2↑
(1)NH3与H2O,CO2反应生成NH4HCO3。
(2)NH4HCO3与NaCl反应生成NaHCO3沉淀。主要原因是NaHCO3的溶解度较小。
(3)在第(2)点中过滤后的滤液中加入NaCl,由于 NH4CI在低温时溶解度非常低,使NH4Cl结晶析出,可做氮肥。
(4)加热NaHCO3得到Na2CO3.
优点:保留了氨碱法的优点,消除了它的缺点,提高了食盐的利用率,NH4Cl可做氮肥,同时无氨碱法副产物CaCl2毁占耕田的问题。
盐是指由金属离子(或钱根离子)和酸根离子构成的化合物,盐在溶液里能解离成金属离子(或钱根离子)和酸根离子。根据阳离子不同,可将盐分为钠盐、钾盐、钙盐、钱盐等,根据阴离子不同,可将盆分为硫酸盐、碳酸盐,硝酸盐等。
生活中常见的盐有:
氯化钠(NaCl),碳酸钠 (Na2CO3)、碳酸氧钠(NaHCO3)、碳酸钙和农业生产上应用的硫酸铜(CuSO4)。
盐的物理性质:
(1)盐的水溶液的颜色常见的盐大多数为白色固体,其水溶液一般为无色。但是有些盐有颜色,其水溶液也有颜色。例如:胆矾(CuSO4·5H2O)为蓝色,高锰酸钾为紫黑色;含Cu2+的溶液一般为蓝色,含Fe2+的溶液一般为浅绿色,含Fe3+的溶液一般为黄色。
(2)盐的溶解性记忆如下钾钠硝钱溶水快(含K+,Na+,NH4+,NO3-的盐易溶于水);硫酸盐除钡银钙(含SO42-的盐中,Ag2SO4, CaSO4微溶,BaSO3难溶)都易溶;氯化物中银不溶(含 Cl-的盐中,AgCl不溶于水,其余一般易溶于水);碳酸盐溶钾钠钱[含CO32-的盐,Na2CO3、(NH4)2CO3、 K2CO3易溶,Na2CO3微溶,其余难溶〕。
盐的化学性质:
(1)盐+金属一另一种盐+另一种金属(置换反应),例如:Fe+CuSO4==FeSO4+Cu
规律:反应物中盐要可溶,金属活动性顺序表中前面的金属可将后面的金属从其盐溶液中置换出来(K, Ca,Na除外)。
应用:判断或验证金属活动性顺序和反应发生的先后顺序。
(2)盐+酸→另一种盐+另一种酸(复分解反应),例如;HCl+AgNO3==AgCl↓+HNO3。
规律:反应物中的酸在初中阶段一般指盐酸、硫酸、硝酸。盐是碳酸盐时可不溶,若是其他盐,则要求可溶。应用:实验室制取CO2,CO32-、Cl-,SO42-的检验。
(3)盐+碱→另一种盐+另一种碱(复分解反应)
规律:反应物都可溶,若反应物中盐不为按盐,生成物其中之一为沉淀或水。
应用:制取某种碱,例如:Ca(OH)2+Na2CO3== CaCO3↓+2NaOH。
(4)盐+盐→另外两种盐
规律:反应物都可溶,生成物至少有一种不溶于水。
应用:检验某种离子或物质。例如:NaCl+AgNO3 =AgCl↓+NaNO3(可用于鉴定Cl-);Na2SO4+BaCl2==BaSO4↓+2NaCl(可用与鉴定SO42-)
几种常见盐的性质及用途比较如下表:
| 氯化钠 | 碳酸钠 | 碳酸氢钠 | 碳酸钙 | 硫酸铜 | |
| 化学式 | NaCl | Na2CO3 | NaHCO3 | CaCO3 | CuSO4 |
| 俗称 | 食盐 | 纯碱、苏打 | 小苏打 | —— | —— |
| 物理性质 | 白色固体,易溶于水。水溶液有咸味,溶解度受温度影响小 | 白色固体,易溶于水 | 白色固体,易溶于水 | 白色固体,不溶于水 | 白色固体,易溶于水,溶液为蓝色,有毒 |
| 化学性质 | 水溶液显中性 AgNO3+NaCl==AgCl↓+NaNO3 |
水溶液显碱性 Na2CO3+2HCl==2NaCl+H2O+CO2↑ Na2CO3+Ca(OH)2==CaCO3↓+2NaOH |
水溶液显碱性 NaHCO3+HCl==NaCl+H2O+CO2↑ |
CaCO3+2HCl==CaCl2+H2O+CO2↑ | CuSO4+5H2O==CuSO4·5H2O CuSO4+Fe==FeSO4+Cu CuSO4+2NaOH==Cu(OH)2↓+Na2SO4 |
| 用途 | 作调味品和防腐剂,医疗上配置生理盐水。重要的化工原料 | 制烧碱,广泛用于玻璃、纺织、造纸等工业 | 焙制糕点的发酵粉的主要成分,医疗上治疗胃酸过多 | 实验室制取CO2,重要的建筑材料,制补钙剂 | 农业上配制波尔多液,实验室中用作水的检验试剂,精炼铜 |
易错点:
①“食盐是盐是对的,但“盐就是食盐”是错误的,化学中的“盐”指的是一类物质。
②石灰石和大理石的主要成分是碳酸钙,它们是混合物,而碳酸钙是纯净物。
③日常生活中还有一种盐叫亚硝酸钠,工业用盐中常含有亚硝酸钠,是一种自色粉末,有咸味,对人体有害,常用作防腐保鲜剂。
④CuSO4是一种白色固体,溶于水后形成蓝色的CuSO4溶液,从CuSO4溶液中结品析出的晶体不是硫酸铜,而是硫酸铜晶休,化学式为CuSO4·5H2O,俗称胆矾或蓝矾,是一种蓝色固体。硫酸铜与水结合也能形成胆矾,颜色由白色变为蓝色.利用这种特性常用硫酸铜固体在化学实验中作检验水的试剂。
盐的命名:
(1)只有两种元素组成的盐,读作“某化某”,如 NaCl读作氯化钠,AgI读作碘化银。
(2)构成中含有酸根的,读作“某酸某”。如Na2CO3、ZnSO4、AgNO3、KMnO4、KClO3分别读作:碳酸钠、硫酸锌、硝酸银、高锰酸钾、氯酸钾。
(3)含铵根的化合物,读作“某化铵”或“某酸铵”。如NH4Cl、(NH4)2SO4读作:氯化铵、硫酸铵。
(4)其他:Cu2(OH)2CO3读作“碱式碳酸铜”, NaHSO4读作“硫酸氢钠”, NaHCO3读作“碳酸氢钠”。
风化:
风化是指结晶水合物在室温和干燥的条件下失去结晶水的现象,这种变化属于化学反应。如 Na2CO3·10H2O==Na2CO3+10H2O;CaSO4·2H2O ==CaSO4+2H2O。
侯氏制碱法:
我国化工专家侯德榜于1938-1940年用了三年时间,成功研制出联合制碱法,后来命名为“侯氏联合制碱法”。其主要原理是:
NH3+CO2+H2O== NH4HCO3
NH4HCO3+NaCl ==NaHCO3↓+NH4CI
2NaHCO3==Na2CO3+H2O+CO2↑
(1)NH3与H2O,CO2反应生成NH4HCO3。
(2)NH4HCO3与NaCl反应生成NaHCO3沉淀。主要原因是NaHCO3的溶解度较小。
(3)在第(2)点中过滤后的滤液中加入NaCl,由于 NH4CI在低温时溶解度非常低,使NH4Cl结晶析出,可做氮肥。
(4)加热NaHCO3得到Na2CO3.
优点:保留了氨碱法的优点,消除了它的缺点,提高了食盐的利用率,NH4Cl可做氮肥,同时无氨碱法副产物CaCl2毁占耕田的问题。
酸碱指示剂:
跟酸或碱的溶液起作用而显示不同颜色的物质,叫酸碱指示剂,通常也简称指示剂。
紫色石蕊试液和无色酚酞试液的显色:
紫色石蕊试液和无色酚酞试液是两种常用的酸碱指示剂,它们与酸性、碱性溶液作用时显示的颜色见下表:
易错点:
①变色的是指示剂,而不是酸或碱的溶液。如盐酸使紫色石蕊试液变红,不能说成紫色石蕊试液使盐酸变红,但可以说紫色石蕊试液遇盐酸变红。
②酸或碱的溶液能使紫色石蕊试液或酚酞试液变色,但能使紫色石蕊试液或酚酞试液变色的不一定是酸或碱的溶液,还可能是酸性盐溶掖或碱性盐溶液。如碳酸钠溶液能使紫色石蕊试液变蓝,但碳酸钠不是碱,而是盐。
酸碱指示剂的代用品:
在自然界里,有许多植物色素在不同的酸碱性溶液中.都会发生特定的颜色变化。这些植物色素可以用作石蕊和酚酞等指示剂的代用品。一些植物的色素及其在酸碱性溶液中的颜色变化如下:
跟酸或碱的溶液起作用而显示不同颜色的物质,叫酸碱指示剂,通常也简称指示剂。
紫色石蕊试液和无色酚酞试液的显色:
紫色石蕊试液和无色酚酞试液是两种常用的酸碱指示剂,它们与酸性、碱性溶液作用时显示的颜色见下表:
| 酸性溶液 | 碱性溶液 | 中性溶液 | |
| 石蕊试液 | 红 | 蓝 | 紫 |
| 酚酞试液 | 无 | 红 | 无 |
易错点:
①变色的是指示剂,而不是酸或碱的溶液。如盐酸使紫色石蕊试液变红,不能说成紫色石蕊试液使盐酸变红,但可以说紫色石蕊试液遇盐酸变红。
②酸或碱的溶液能使紫色石蕊试液或酚酞试液变色,但能使紫色石蕊试液或酚酞试液变色的不一定是酸或碱的溶液,还可能是酸性盐溶掖或碱性盐溶液。如碳酸钠溶液能使紫色石蕊试液变蓝,但碳酸钠不是碱,而是盐。
酸碱指示剂的代用品:
在自然界里,有许多植物色素在不同的酸碱性溶液中.都会发生特定的颜色变化。这些植物色素可以用作石蕊和酚酞等指示剂的代用品。一些植物的色素及其在酸碱性溶液中的颜色变化如下:
| 代用指示剂的颜色 | |||
| 在酸性溶液中 | 在中性溶液中 | 在碱性溶液中 | |
| 牵牛花 | 红色 | 紫色 | 蓝色 |
| 苏木 | 黄色 | 红棕色 | 玫瑰红色 |
| 紫萝卜皮 | 红色 | 紫色 | 黄绿色 |
| 月季花 | 浅红色 | 红色 | 黄色 |
| 美人蕉 | 淡红色 | 红色 | 绿色 |
中和反应:
(1)定义:酸跟碱作用生成盐和水的反应,叫做中和反应。
(2)实质:酸中的氢离子与碱中的氢氧根离子作用生成水的过程。
概念理解:
①中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应。如Fe2O3+6HCl==2FeCl3+3H2O不是中和反应
②中和反应一定是复分解反应,但复分解反应不一定是中和反应。二者的关系是复分解反应包含了中和反应。
探究中和反应是否发生的方法:
酸与碱作用生成盐和水的反应叫中和反应,中和反应一般情况下没有明显的外观现象【H2SO4+ Ba(OH)2==BaSO4↓+2H2O除外】。
探究酸碱发生中和反应的方法有以下几种(以HCl和NaOH反应为例):
1. 指示剂法。先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
2. pH试纸法。先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时多次测定混合溶液的pH。如果测得pH逐渐变小且小于7,则证明 NaOH溶液与稀盐酸发生了化学反应。
3. 热量变化法。化学反应通常伴随着能量的变化.所以可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
中和反应的应用:
①改变土壤的酸碱性根据土壤情况,可以利用中和反应,在土壤中加人适量酸性或碱性物质,调节土壤的酸碱性,以利于植物生长。如:近年来由于空气污染造成的酸雨,导致一些地方的土壤显酸性,不利于农作物生长,人们通常向土壤中撒适量熟石灰中和其酸性。
②处理工厂的废水工厂里排出的废水有一些显酸性或碱性,直接排放会对水体和环境造成污染。通常在排出的废水中加入适量的碱性或酸性物质中和。如:废水中含有硫酸可向其中加人适从熟石灰,反应的化学方程式为:H2SO4+Ca(OH)2==CaSO4+2H2O。
③用于医药人体胃酸(主要成分是盐酸)过多,会造成消化不良,甚至会产生胃病,通常服用呈碱性的物质来消除症状,如氢氧化铝,反应的化学方程式为:3HCl+Al(OH)3== AlCl3+3H2O。被蚊虫叮咬(蚊虫能分泌出蚁酸)后,可在患处涂上显碱胜的物质,如:NH3·H2O。
(1)定义:酸跟碱作用生成盐和水的反应,叫做中和反应。
(2)实质:酸中的氢离子与碱中的氢氧根离子作用生成水的过程。
概念理解:
①中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应。如Fe2O3+6HCl==2FeCl3+3H2O不是中和反应
②中和反应一定是复分解反应,但复分解反应不一定是中和反应。二者的关系是复分解反应包含了中和反应。
探究中和反应是否发生的方法:
酸与碱作用生成盐和水的反应叫中和反应,中和反应一般情况下没有明显的外观现象【H2SO4+ Ba(OH)2==BaSO4↓+2H2O除外】。
探究酸碱发生中和反应的方法有以下几种(以HCl和NaOH反应为例):
1. 指示剂法。先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
2. pH试纸法。先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时多次测定混合溶液的pH。如果测得pH逐渐变小且小于7,则证明 NaOH溶液与稀盐酸发生了化学反应。
3. 热量变化法。化学反应通常伴随着能量的变化.所以可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
中和反应的应用:
①改变土壤的酸碱性根据土壤情况,可以利用中和反应,在土壤中加人适量酸性或碱性物质,调节土壤的酸碱性,以利于植物生长。如:近年来由于空气污染造成的酸雨,导致一些地方的土壤显酸性,不利于农作物生长,人们通常向土壤中撒适量熟石灰中和其酸性。
②处理工厂的废水工厂里排出的废水有一些显酸性或碱性,直接排放会对水体和环境造成污染。通常在排出的废水中加入适量的碱性或酸性物质中和。如:废水中含有硫酸可向其中加人适从熟石灰,反应的化学方程式为:H2SO4+Ca(OH)2==CaSO4+2H2O。
③用于医药人体胃酸(主要成分是盐酸)过多,会造成消化不良,甚至会产生胃病,通常服用呈碱性的物质来消除症状,如氢氧化铝,反应的化学方程式为:3HCl+Al(OH)3== AlCl3+3H2O。被蚊虫叮咬(蚊虫能分泌出蚁酸)后,可在患处涂上显碱胜的物质,如:NH3·H2O。
发现相似题
与“下列推论正确的是( )A.碳酸盐与盐酸反应放出气体,所以与...”考查相似的试题有:
- 下列安全措施不正确的是A.燃放烟花爆竹时,远离人群和可燃物B.正在使用的家用电器着火,立即用水浇灭C.进入久未开启的菜窖...
- 星期天我跟妈妈学炒菜,我先打开了天然气燃气灶,天然气主要成分燃烧的化学方程式为 _。炒菜时我不小心把油锅弄着了火,我应...
- 有一固体混合物A,已知其中可能含有MgCl2、CuSO4、CaCO3、FeCl3四种物质中的两种或多种。按照下图所示进行实验,出现的现象如...
- 化学小组的同学利用如图所示装置进行实验。集气瓶中装有纯净物A,分液漏斗中盛有物质B。(1)若A、B均为液体。将B滴入集气瓶...
- 物间的转化,不能一步实现的是( )A.MgSO4→MgCl2B.Na2CO3→NaOHC.CaCO3→Ca(OH)2D.Fe(OH)3→FeCl3
- 目前,许多地区都筹建了生态农业科技园区,这些园区不仅是农业新技术示范和推广基地,也将是一个观光休闲的生态农业园区.下...
- 已知水壶里的水垢主要成分是一种含钙的化合物,请你设计一个实验探究水垢的主要成分.提出假设验证方法及操作实验现象结论假...
- 下列几组溶液,不用其它任何试剂就可以鉴别出来的是( )A.CaCl2KNO3Na2CO3KClB.FeCl3Na2SO4KNO3NaOHC. NaOH CuSO4NaCl Mg...
- 下列有关实验操作中,正确的是( )A.稀释浓硫酸时,将浓硫酸慢慢注入盛有水的量筒中B.用胶头滴管向试管中滴加液体时,把滴...
- 小海看到妈妈炒的紫色卷心菜,紫色菜汁因为加醋而变成红色,洗盘子时遇到碱性洗涤剂又变成黄绿色。下列也能使紫色菜汁呈黄绿...