本试题 “化学方程式可简明地体现元素及其化合物的性质。已知:氧化还原反应:2FeCl3+ 2HI = 2FeCl2+ I2+ 2HCl; 2Co(OH)3+ 6HCl = 2CoCl2+ Cl2↑ + 6H2O2Fe(OH)2 + I2+...” 主要考查您对氧化性、还原性强弱的比较
分解反应
溶液的酸碱性
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化性、还原性强弱的比较
- 分解反应
- 溶液的酸碱性
分解反应:
一种化合物在特定条件下(如加热、通直流电、催化剂等)分解成两种或两种以上较简单的单质或化合物的反应
分解反应类型:
氧化物分解: 2H2O=(通电)2H2↑+O2↑ 2H2O2=(MnO2)2H2O+O2↑
含氧酸分解: H2CO3=(△)H2O+CO2↑ H2SO3=(△)H2O+SO2↑
碱的分解: Mg(OH)2=(高温)MgO+H2O Cu(OH)2=(△)CuO+H2O 2Fe(OH)3=(高温)Fe2O3+3H2O
2Al(OH)3=(高温)Al2O3+3H2O (注:不溶性碱高温时可分解为金属氧化物和水)
盐的分解: 2NaHCO3=(△)Na2CO3+CO2↑+H2O Ca(HCO3)2=(△)CaCO3+CO2↑+H2O CaCO3=(高温)CaO+CO2↑
2KMnO4=(△)K2MnO4+MnO2+O2↑ 2KClO3=(△,MnO2)2KCl+3O2↑
分解反应的模型:
A=B+C 可以简单理解为“一变多”,也可以理解成为由一种反应物发生化学反应后生成两种或两种以上的物质的反应。
分解反应与氧化还原反应的关系:
分解反应不一定是氧化还原反应,例如:2Al(OH)3=(高温)Al2O3+3H2O
只有能产生单质的分解反应才是氧化还原反应,例如:2H2O=(通电)2H2↑+O2↑
(1)pH=-lg[c(H+)],在溶液的c(H+)很小时,用pH来表示溶液的酸度。
(2)pH越大,c(H+)越小,c(OH-)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
(3)pH的范围:0~14
(4)溶液酸碱性判断:
当c(H+)>c(OH-)时,溶液呈酸性;
当c(H+)>=c(OH-)时,溶液呈键性;
当c(H+)<c(OH-)时,溶液呈中性。
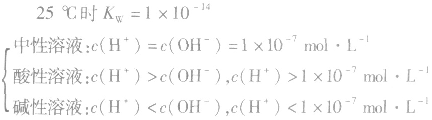
(5)关于pH相同的酸(含强酸和弱酸)
①溶液中c(H+)相等(填“相等”或“不等”)。
②溶液中溶质的物质的量的浓度:强酸<弱酸(填“>”或“<”)。
③耗碱规律:pH和溶液体积均相同的HCl、H2SO4、CH3COOH与碱完全反应时,消耗碱物质的量最多的是CH3COOH。
④稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m,强酸中c(H+)变为原来的1/m,但弱酸中c(H+)减小小于(填“大于”或“小于”)m倍,故稀释后弱酸酸性强于强酸。
溶液的pH:
1.定义:溶液里H+的物质的量浓度的负对数叫做pH。
2.表达式:
3.含义: pH越大,c(H+)越小,c(O-一)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
4.适用范围:
c(H+)很小时,用pH来表示溶液的酸碱度更方便。所以,pH适用于酸、碱的稀溶液
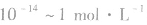 之间],pH取值范刚为0~14。
之间],pH取值范刚为0~14。
5.溶液的酸碱性和pH: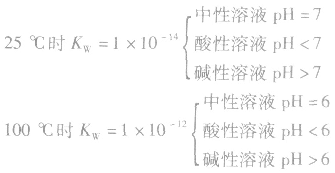
与“化学方程式可简明地体现元素及其化合物的性质。已知:氧化还...”考查相似的试题有:
- 下列装置所示的实验不能达到目的是( )A.装置①定量测定化学反应速率B.装置②验证Na和水反应放热C.装置③比较KMnO4、Cl2、S...
- 用双线桥表示下列反应中得失电子的情况,并指明氧化剂、还原剂、氧化产物、还原产物:3FeO + 10HNO3=== 3Fe(NO3)3+ NO↑ + 5H2...
- 已知下列两个反应:①Cl2+2KI=I2+2KCl ②I2+2KClO3=Cl2+2KIO3.下列说法中不正确的是( )A.①②均属于置换反应B.①中的I2是氧化...
- 根据下图实验现象,所得结论不正确的是[ ]实验现象 结论A.左过烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 活动性:Al>Fe...
- 2010年诺贝尔化学奖授予美日科学家,他们由于研究“有机物合成过程中钯催化交叉偶联”而获奖。钯的化合物氯化钯可用来检测有毒...
- 右表是元素周期表的一部分。(1)表中元素⑩的氢化物的化学式为_________ ,此氢化物的还原性比元素⑨的氢化物的还原性________...
- 下列叙述正确的是[ ]A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)B.两种醋酸溶液的物质的量浓度分别为c1...
- 某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH大于7,下表中判断合理的是[ ]A.①③B.②③C.①④D.②④
- 现有浓度为0.1 mol·L-1的五种电解质溶液: ① Na2CO3② NaHCO3③ NaAlO2④ CH3COONa ⑤ NaOH(1)这五种溶液的pH由小到大的顺序...
- 有pH= 12的NaOH溶液 100mL,要使它的pH降为11。(1)若加入蒸馏水,应加__________mL。(2)若加入pH为10的NaOH溶液,应加_______...