本试题 “如图4位同学对分子、原子离子的描述,其中正确的是( )A.B.C.D.” 主要考查您对原子结构
离子符号的意义及写法
构成物质的微粒(分子、原子、离子)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 原子结构
- 离子符号的意义及写法
- 构成物质的微粒(分子、原子、离子)
原子的构成:

原子核的构成:

原子核相对原子来说,体积很小,但质量却很大,原子的质量主要集中在原子核上,电子的质量约为质子质量的 。
。
质子的质量为:1.6726×10-27kg
中子的质量为:1.6749×10-27kg
构成原子的粒子间的关系:

对原子构成的正确理解:
(1)原子核位于原子中心,绝大多数由质子和中构成 (有一种氢原子的原子核内只含有1个质子,无中子),体积极小,密度极大,几乎集中了原子的全部质量,核外电子质量很小,可以忽略不计。
(2)每个原子只有一个原子核,核电荷数(核内质子数)的多少,决定了原了的种类。
(3)在原子中:核电荷数二质子数二核外电子数。
(4)原子核内的质子数不一定等干中子数,如钠原子中,质子数为11,中子数为12。
(5)并不是所有的原子中都有中子,如有一种氢原子中就没有中子。
(6)在原子中,由于质子(原子核)与电子所带电荷数相等,且电性相反,因而原子中虽然存在带电的粒子,但原子在整体上不显电性。
核外电子的排布:
①电子层核外电子运动有自己的特点,在含有多个电子的原子里,有的电子通常在离核较近的区域运动,有的电子通常在离核较远的区域运动,科学家形象地将这些区域称为电子层。
②核外电子的分层排布通常用电子层来形象地表示运动着的电子离核远近的不同:离核越近,电子能量越低;离核越远,电子能量越高。电子层数、离核远近、能量高低的关系如下所示:
电子层数 1 2 3 4 5 6 7
离核远近 近→ 远
能量高低 低→ 高
③核外电子排布的规律了解一些核外电子排布的简单规律对理解原子核外电子排布的情况有很重要的作川,核外电子排布的简单规律主要有:
a.每层上的电子数最多不超过2n2(n为电子层数),如第一电子层上的电子数可能为1,也可能为2,但最多为2。
b.核外电子排布时先排第一层,排满第一层后,再排第二层,依次类推。
c.最外层上的电子数不超过8;当只有一个电子层时,最外层上的电子数不超过2。

原子的不可再分与原子的结构:
化学变化中原子不会由一种原子变成另外一种原子,即化学变化中原了的种类不变,其原因是化学变化中原子核没有发生变化。如硫燃烧生成了二氧化硫,硫和氧气中分别含有硫原子和氧原子,反应后生成的二氧化硫中仍然含硫原子和氧原子。原子不是最小粒子,只是在化学变化的范围内为“最小粒子”,它还可再分,如原子弹爆炸时的核裂变,就是原子发生了变化。原子尽管很小,但具有一定的构成,是由居于原子中心的带正电的原子核和核外带负电的电子构成的。

原子核的构成:

原子核相对原子来说,体积很小,但质量却很大,原子的质量主要集中在原子核上,电子的质量约为质子质量的
 。
。质子的质量为:1.6726×10-27kg
中子的质量为:1.6749×10-27kg
构成原子的粒子间的关系:

对原子构成的正确理解:
(1)原子核位于原子中心,绝大多数由质子和中构成 (有一种氢原子的原子核内只含有1个质子,无中子),体积极小,密度极大,几乎集中了原子的全部质量,核外电子质量很小,可以忽略不计。
(2)每个原子只有一个原子核,核电荷数(核内质子数)的多少,决定了原了的种类。
(3)在原子中:核电荷数二质子数二核外电子数。
(4)原子核内的质子数不一定等干中子数,如钠原子中,质子数为11,中子数为12。
(5)并不是所有的原子中都有中子,如有一种氢原子中就没有中子。
(6)在原子中,由于质子(原子核)与电子所带电荷数相等,且电性相反,因而原子中虽然存在带电的粒子,但原子在整体上不显电性。
核外电子的排布:
①电子层核外电子运动有自己的特点,在含有多个电子的原子里,有的电子通常在离核较近的区域运动,有的电子通常在离核较远的区域运动,科学家形象地将这些区域称为电子层。
②核外电子的分层排布通常用电子层来形象地表示运动着的电子离核远近的不同:离核越近,电子能量越低;离核越远,电子能量越高。电子层数、离核远近、能量高低的关系如下所示:
电子层数 1 2 3 4 5 6 7
离核远近 近→ 远
能量高低 低→ 高
③核外电子排布的规律了解一些核外电子排布的简单规律对理解原子核外电子排布的情况有很重要的作川,核外电子排布的简单规律主要有:
a.每层上的电子数最多不超过2n2(n为电子层数),如第一电子层上的电子数可能为1,也可能为2,但最多为2。
b.核外电子排布时先排第一层,排满第一层后,再排第二层,依次类推。
c.最外层上的电子数不超过8;当只有一个电子层时,最外层上的电子数不超过2。

原子的不可再分与原子的结构:
化学变化中原子不会由一种原子变成另外一种原子,即化学变化中原了的种类不变,其原因是化学变化中原子核没有发生变化。如硫燃烧生成了二氧化硫,硫和氧气中分别含有硫原子和氧原子,反应后生成的二氧化硫中仍然含硫原子和氧原子。原子不是最小粒子,只是在化学变化的范围内为“最小粒子”,它还可再分,如原子弹爆炸时的核裂变,就是原子发生了变化。原子尽管很小,但具有一定的构成,是由居于原子中心的带正电的原子核和核外带负电的电子构成的。
离子的定义:
带电的原子或原子团叫离子。
离子的分类:
阳离子:带正电荷的原子或原子团,如:K+、NH4+
阴离子:带负电荷的原子或原子团,如:Cl-、SO42-。
离子的形成(以Na+、Cl-的形成为例) :
①钠在氯气中燃烧生成氯化钠:2Na+Cl2 2NaCl。钠与氯气反应时,每个钠原子失去1个电子形成钠离子(Na+),每个氯原子得到1个电子形成氯离子(Cl-),Na+与Cl-由于静电作用而结合成化合物氯化钠(NaCl)
2NaCl。钠与氯气反应时,每个钠原子失去1个电子形成钠离子(Na+),每个氯原子得到1个电子形成氯离子(Cl-),Na+与Cl-由于静电作用而结合成化合物氯化钠(NaCl)

②从原子结构示意图分析Na+,Cl-的形成过程:

离子的表示方法——离子符号
在元素符号的右上角用“+”,“-”号表示离子的电性,数字表示离子所带的电荷,先写数字后写正负号,当数字为1 时,省略不谢。如Na+,Cl-,Mg2+,O2-。
原子团:
①有一些物质如Ca(OH)2,CaCO3等,它们中的一些原子集团如OH-、CO32-,常作为一个整体参加反应,这样的原子集团,叫做原子团,又叫做根。
②命名:原子团不能独立稳定地存在,它是物质 “分子”组成的一部分。
初中化学中的原子团除铵根 (NH4+)在化学式前面部分外,其他原子团在化学式的后一部分一般命名“xx根”,
如下面画线部分为原子团: NH4Cl(铵根)Na2CO3(碳酸根)K2SO4(硫酸根)NaOH(氢氧根)KNO3(硝酸根)KMnO4(高锰酸根)K2MnO4(锰酸根)KClO3(氯酸根) NH4NO3(铵根,硝酸根)
其他原子团有:SO32-(亚硫酸根)、NO2-(亚硝酸根),HSO3-(亚硫酸氢根),H2PO4-(磷酸二氢根)等。
关系式:
阳离子所带正电荷数=原子失去电子数=质子数-核外电子数
阴离子所带负电荷数=原子得到电子数=核外电子数-质子数
带电的原子或原子团叫离子。
离子的分类:
阳离子:带正电荷的原子或原子团,如:K+、NH4+
阴离子:带负电荷的原子或原子团,如:Cl-、SO42-。
离子的形成(以Na+、Cl-的形成为例) :
①钠在氯气中燃烧生成氯化钠:2Na+Cl2
 2NaCl。钠与氯气反应时,每个钠原子失去1个电子形成钠离子(Na+),每个氯原子得到1个电子形成氯离子(Cl-),Na+与Cl-由于静电作用而结合成化合物氯化钠(NaCl)
2NaCl。钠与氯气反应时,每个钠原子失去1个电子形成钠离子(Na+),每个氯原子得到1个电子形成氯离子(Cl-),Na+与Cl-由于静电作用而结合成化合物氯化钠(NaCl)
②从原子结构示意图分析Na+,Cl-的形成过程:

离子的表示方法——离子符号
在元素符号的右上角用“+”,“-”号表示离子的电性,数字表示离子所带的电荷,先写数字后写正负号,当数字为1 时,省略不谢。如Na+,Cl-,Mg2+,O2-。
原子团:
①有一些物质如Ca(OH)2,CaCO3等,它们中的一些原子集团如OH-、CO32-,常作为一个整体参加反应,这样的原子集团,叫做原子团,又叫做根。
②命名:原子团不能独立稳定地存在,它是物质 “分子”组成的一部分。
初中化学中的原子团除铵根 (NH4+)在化学式前面部分外,其他原子团在化学式的后一部分一般命名“xx根”,
如下面画线部分为原子团: NH4Cl(铵根)Na2CO3(碳酸根)K2SO4(硫酸根)NaOH(氢氧根)KNO3(硝酸根)KMnO4(高锰酸根)K2MnO4(锰酸根)KClO3(氯酸根) NH4NO3(铵根,硝酸根)
其他原子团有:SO32-(亚硫酸根)、NO2-(亚硝酸根),HSO3-(亚硫酸氢根),H2PO4-(磷酸二氢根)等。
关系式:
阳离子所带正电荷数=原子失去电子数=质子数-核外电子数
阴离子所带负电荷数=原子得到电子数=核外电子数-质子数
构成物质的微粒:
分子、原子、离子是构成物质的基本微粒。
分子,原子,离子的比较:
分子和原子的比较:
原子与离子的比较:
分子、原子、离子是构成物质的基本微粒。
分子,原子,离子的比较:
| 分子 | 原子 | 离子 | |
| 概念 | 保持物质化学性质的最小粒子 | 是化学变化中的最小粒子 | 带电的原子或原子团 |
| 表示方法 | 用化学式表示. 如H2,He | 用元素符号表示,如H,Fe | 用离子符号表示,如Na+、NO3- |
| 微粒的运动 | 物理变化是分子运动的结果,如:水的蒸发 | 化学变化是原子运动的结果. 如:水的电解 | 离子运动的结果可能是物理变化。也可能是化学变化,如:NaCl的溶解是物理变化, NaCl与AgNO3反应是化学变化 |
| 化学计量数与符号的关系 | 化学式、元素符号、离子符号前加上化学计量数,如2H,2H2,3Na+,只表示原子、分子、离了的“个数”,不表示元素和物质 | ||
| 联系 |  | ||
分子和原子的比较:
| 原子 | 分子 | |
| 定义 | 化学变化中的最小粒子 | 保持物质(由分子直接构成的物质)化学性质的最小粒子 |
| 相同点 | ①都是构成物质的基本粒子,有些物质是由分子构成的.有些物质是由原子直接构成的; ②都很小,但者阶一定的体积和质量; ③都在不断地运动; ④微粒子间都有间隔; ⑤都能保持物质的化学性质 | |
| 区别 | 化学变化中不能再分 | 化学变化中可以再分 |
| 如:在电解水实验中,水分子可以分成氢原子和氧原子,而氢原子和氧原子不可以再分,只是重新组合成氢分子、氧分子 | ||
| 同种原子具有相同的质子数 | 同种分子化学性质相同 | |
| 联系 | 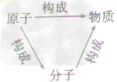 | |
原子与离子的比较:
| 原子 | 离子 | |
| 概念 | 化学变化中最小粒子 | 带电荷的原子或原子团 |
| 电性 | 呈电中性,不带电 | 带电: 阳离子带正电 阴离子带负电 |
| 表示方法 | 用元素符号表示;Na 表示钠原子,2Na表示2个钠原子 | 在元素符号右上角先写电荷数,后标出电性 (+、-):Na+表示钠离子,2Na+表示2个钠离子 |
| 数量关系 | 核内质子数=核外电子数 | 阳离子:核内质子数> 核外电子数 阴离子:核内质子数< 核外电子数 |
| 相似点 | 都是构成物质的一种粒子 | |
| 转化 |  | |
发现相似题
与“如图4位同学对分子、原子离子的描述,其中正确的是( )A.B...”考查相似的试题有:
- 从20 世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料。请回答下列问题:(1) 地壳里各种元素的含量(质...
- 如图为丙氨酸分子结构模型,下列关于丙氨酸说法不正确的是( )A.丙氨酸是由碳原子、氢原子、氧原子和氮原子多原子分子构成...
- 下列说法完全正确的是( )A、氖气的化学式-Ne2硅的元素符号-Si2个氮气分子--2N2B、决定元素种类--质子数决定元素的化学性质-...
- 化学知识中有很多的“相等”.下列叙述正确的是( )A.铁丝在氧气中燃烧,反应前后固体的质量相等B.同种元素的原子与离子(如...
- 下列离子符号书写正确的是[ ]A.Na1+B.OH﹣1C.SO42﹣D.Al3
- “疏影横斜水清浅,暗香浮动月黄昏”出自北宋诗人林逋的七律《山园小梅》,诗人远远就能闻到梅花散发的香味,说明( )A.分子...
- 水是由大量的______构成的,化学符号是______.一个水分子由______和______构成.
- 元素、原子、分子等概念之间有联系和区别,有关描述正确的是( )A.物质是由元素构成的B.分子、原子都是构成物质的微粒C....
- 牙膏中的含氟化合物对牙齿有保护作用。一种氟原子的原子核内有9个质子和10个中子,该原子的核电荷数为A.7B.9C.10D.19
- 下列物质含有氧分子的是:A.过氧化氢B.氢气和氧气的混合气C.水D.高锰酸钾