本试题 “铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”又称“孔雀石”,化学式为Cu2(OH)2CO3,铜绿能跟酸反应生成铜盐及CO2、H2O。...” 主要考查您对氧化还原反应的定义
复分解反应
单质铜
碱式碳酸铜
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化还原反应的定义
- 复分解反应
- 单质铜
- 碱式碳酸铜
氧化还原反应:
有电子转移(得失或偏移)的反应;(无电子转移(得失或偏移)的反应为非氧化还原反应)
反应历程:
氧化还原反应前后,元素的氧化数发生变化。根据氧化数的升高或降低,可以将氧化还原反应拆分成两个半反应:氧化数升高的半反应,称为氧化反应;氧化数降低的反应,称为还原反应。氧化反应与还原反应是相互依存的,不能独立存在,它们共同组成氧化还原反应。
氧化还原反应中存在以下一般规律:
强弱律:氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
价态律:元素处于最高价态,只具有氧化性;元素处于最低价态,只具有还原性;处于中间价态,既具氧化性,又具有还原性。
转化律:同种元素不同价态间发生归中反应时,元素的氧化数只接近而不交叉,最多达到同种价态。
优先律:对于同一氧化剂,当存在多种还原剂时,通常先和还原性最强的还原剂反应。守恒律:氧化剂得到电子的数目等于还原剂失去电子的数目。
氧化还原性的强弱判定:
物质的氧化性是指物质得电子的能力,还原性是指物质失电子的能力。物质氧化性、还原性的强弱取决于物质得失电子的能力(与得失电子的数量无关)。从方程式与元素性质的角度,氧化性与还原性的有无与强弱可用以下几点判定:
(1)从元素所处的价态考虑,可初步分析物质所具备的性质(无法分析其强弱)。最高价态——只有氧化性,如H2SO4、KMnO4中的S、Mn元素;最低价态,只有还原性,如Cl-、S2-等;中间价态——既有氧化性又有还原性,如Fe、S、SO2等。
(2)根据氧化还原的方向判断:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
(3)根据反应条件判断:当不同的氧化剂与同一种还原剂反应时,如氧化产物中元素的价态相同,可根据反应条件的高、低进行判断,如是否需要加热,是否需要酸性条件,浓度大小等等。
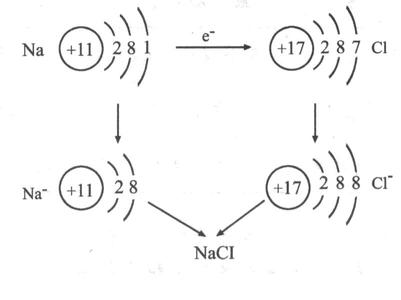
电子的得失过程:

其过程用核外电子排布变化情况可表示为:
复分解反应的定义:
复分解反应是由两种化合物,通过互相交换成分并生成两种新化合物的反应,模式为AB+CD→AD+CB。它是基本类型的化学反应之一。复分解都不是氧化还原反应。
复分解反应发生的条件:
1.生成难溶的物质:如生成BaSO4、AgCl、CaCO3等沉淀。
2.生成气体或易挥发物质:如生成CO2、H2S等气体。
3.有弱电解质生成:如生成H2O、弱酸、弱碱等。
复分解反应的分类:
- 酸与盐 例如:2HCl+CaCO3=CaCl2+H2O+CO2↑
- 酸与碱 例如:H2SO4+Ba(OH)2=BaSO4↓+2H2O
- 盐与盐(可溶) 例如:Na2CO3+CaCl2=2NaCl+CaCO3↓
- 盐与碱 例如:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
- 酸与金属氧化物 例如:盐酸除铁锈:Fe2O3+6HCl=2FeCl3+3H2O
复分解反应的模型:
AB+CD→AD+CB
复分解反应与氧化还原反应的关系:
复分解都不是氧化还原反应。
铜元素:
在元素周期表中的位置:铜的原子序数29,位于周期表中第四周期,第IB族。
(1)物理性质:有金属光泽,紫红色固体,密度较大,导电导热性能很好,具有很好的延展性,铜属于重金属、有色金属、常见金属,不能被磁铁吸引。
(2)化学性质: 铜常见的化合价为+1价和+2价
①在加热条件下,铜可与多种非金属单质反应。一般来说,遇到氧化性较弱的非金属,铜显较低化合价;遇到氧化性较强的非金属,铜显较高化合价。例如:与强氧化剂反应(如Cl2 Br2等)生成+2价铜的化合物。如:
Cu+Cl2 CuCl2 2Cu+O2
CuCl2 2Cu+O2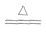 2CuO
2CuO
②铜与酸反应:铜只能被氧化性酸中的中心元素氧化。例如: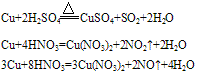
③铜与盐溶液反应:
Cu+2AgCl CuCl2+2Ag
CuCl2+2Ag
铜与铁的对比:
从金属活性顺序表:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au可知,金属铁的金属活性比铜强,所以单质Fe可以从Cu的溶液中还原出单质来,例如: Fe+CuCl2 FeCl2+Cu
FeCl2+Cu
即Fe的还原性强于Cu
铜与浓硫酸和稀硫酸的反应:
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
2Cu+O2+2H2SO4(稀) 2CuSO4+2H2O
2CuSO4+2H2O
注意:从金属活性顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au 可知,铜不能与稀硫酸发生反应,但是在有氧气和加热的条件下可以反应
铜与铜的化合物之间的转换图: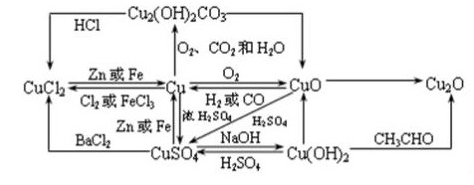
铜的制备和精炼:
(1)工业炼铜法:CuO+CO Cu+CO2
Cu+CO2
(2)湿法炼铜:Fe+CuSO4 FeSO4+Cu
FeSO4+Cu
(3)高温炼铜:工业上用高温冶炼黄铜矿的方法获得铜(粗铜):
2CuFeS2+4O2 Cu2S+3SO2+2FeO(炉渣)
Cu2S+3SO2+2FeO(炉渣)
2Cu2S+3O2 2Cu2O+2SO2
2Cu2O+2SO2
2Cu2O+Cu2S 6Cu+SO2↑
6Cu+SO2↑
备注:粗铜中铜的的含量为99.5%-99.7%,主要含有Ag、Zn、Au等杂质,粗铜通过电解精炼可得到纯度达99.95%-99.98%的铜,原理为用粗铜作阳极,失去电子变为Cu2+,用纯铜棒作阴极即可得精铜。
碱式碳酸铜:
碱式碳酸铜又称碳酸铜,呈孔雀绿颜色,所以又叫孔雀石,是一种名贵的矿物宝石。它是铜与空气中的氧气、二氧化碳和水等物质反应产生的物质,又称铜锈,颜色翠绿。在空气中加热会分解为氧化铜、水和二氧化碳。溶于酸并生成相应的铜盐。在自然界中以孔雀石的形式存在。
碱式碳酸铜的物理性质和化学性质:
(1)物理性质:是一种草绿色的纤维状的团状物或深绿色的粉状物,有毒,是铜锈(铜绿)的主要成分,俗称孔雀石。
(2)化学性质:Cu2(OH)2CO3可溶于酸、热水中,加热到220℃时分解为氧化铜、水和二氧化碳 [Cu2(OH)2CO3 2CuO+CO2↑+H2O↑,溶于酸生成相应的铜盐,也可溶于氰化物、铵盐而形成铜的配合物。
2CuO+CO2↑+H2O↑,溶于酸生成相应的铜盐,也可溶于氰化物、铵盐而形成铜的配合物。
碱式碳酸铜的用途:
碱式碳酸铜可用来制造信号弹、焰火、油漆颜料、杀虫剂和解毒剂,也用于电镀等方面。
与“铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”...”考查相似的试题有:
- 下列反应中,不属于氧化还原反应的是( )A.2Na+O2 点燃 . Na2O2B.Cl2+2NaOH=NaCl+NaClO+H2OC.2Na2O2+2H2O=4NaOH+O2↑D.2F...
- 新型净水剂-高铁酸钾(K2FeO4)为暗紫色固体,可溶于水.工业上制备K2FeO4的常用方法之一是次氯酸盐氧化法:①2FeCl3+10NaOH+3...
- 化学反应也可以按不同的角度进行分类,便于了解各类物质的共性和各类反应的本质。按反应物和生成物的类别以及前后物质种类的...
- 实验证明铜在低温下不能和O2发生反应,也不能和稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀硫酸中并不断通入空气来...
- W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有...
- 在FeCl3和CuSO4溶液中加入过量的铁粉,经过滤后测定反应前后溶液的质量不变(不计过滤损失)。则原来溶液中FeCl3和CuSO4的物...
- 下列说法错误的是;A.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2B.硅酸盐NaAlSiO4·nH2O...
- 100毫升含HNO3、H2SO4的稀溶液中,加入9.6克铜充分反应,铜全溶,产生2.24升NO(标准状况)。同体积的混合酸恰好与250毫升2m...
- 等质量的铜片,在酒精灯上加热后,分别插入下列溶液中,放置片刻后取出,铜片质量与加热前相同的是A.石灰水B.无水乙醇C.硝...
- (15分)现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条...