本试题 “下列四组实验,根据实验事实得出的结论,正确的是[ ]A.在未知试液中滴加BaCl2,取该白色沉淀加稀盐酸不溶解,说明原未知试液中含有SO42-。B.在五水硫酸铜中...” 主要考查您对二氧化硫
(浓)硫酸
离子的检验
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 二氧化硫
- (浓)硫酸
- 离子的检验
①化学式:SO2
②分子结构:SO2是由极性键形成的极性分子,因此易溶于水,其晶体为分子晶体。
二氧化硫的物理性质和化学性质:
1.物理性质:
SO2是无色、有刺激性气味的有毒气体,密度比空气大,易溶于水(常温常压下,1体积水大约溶解40体积的SO2),易液化(沸点-10℃)。
2.化学性质
(1)具有酸性氧化物的通性
①将SO2通入紫色石蕊试液中,试液变红。
②能与碱性氧化物、碱及某些盐反应。如:
(2)还原性 

(3)弱氧化性 
(4)漂白性(不能漂白酸碱指示剂) 能和某些有色物质化合生成无色物质,生成的无色物质不稳定,易分解而恢复原色,因此,SO2的漂白并不彻底。在中学化学常见试剂中,能用SO2漂白的只有品红溶液,品红溶液 无色溶液
无色溶液 恢复原色。
恢复原色。
SO2与一些物质反应的实验现象:


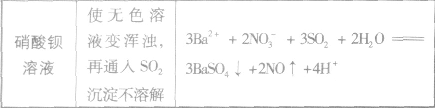
SO2与强碱反应后固体成分的确定:
SO2与强碱(如NaOH)溶液发生反应后的固体成分取决于二者的用量。遇到类似的问题,可以采用数轴分析法讨论。设SO2的物质的量为n(SO2),NaOH物质的量为n(NaOH),数轴代表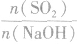 ,如下数轴所示:
,如下数轴所示: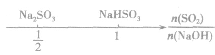
分析数轴可得:
(1)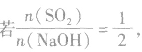 则固体物质为Na2SO3,
则固体物质为Na2SO3,
(2)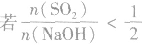 ,则固体物质为NaOH 和Na2SO3.
,则固体物质为NaOH 和Na2SO3.
(3)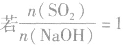 ,则同体物质为NaHSO3
,则同体物质为NaHSO3
(4)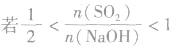 ,则固体物质为Na2SO3和NaHSO3,
,则固体物质为Na2SO3和NaHSO3,
(5)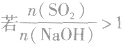 ,则固体物质为NaHSO3。
,则固体物质为NaHSO3。
二氧化硫的制备:
工业制法:

实验室制法:
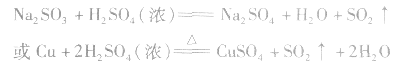
(1)收集:向上排空气法。
(2)检验:品红溶液。SO2是中学阶段学到的唯一种既能使品红褪色,加热后又能使其恢复原色的气体。
(3)尾气处理:用NaOH溶液吸收。
二氧化硫的用途:
工业上用二氧化硫漂白纸浆、毛、丝、草编制品等。此外,二氧化硫还可用于杀菌消毒,可以用作防腐剂。
二氧化硫对环境的污染及治理:

硫酸:
硫酸的分子式:H2SO4;结构式: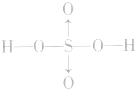 ,H2SO4中硫元素为+6价,处于最 0 高价,具有氧化性,但只有浓H2SO4表现出强氧化性,而稀硫酸、硫酸盐巾的硫元素通常不表现氧化性。
,H2SO4中硫元素为+6价,处于最 0 高价,具有氧化性,但只有浓H2SO4表现出强氧化性,而稀硫酸、硫酸盐巾的硫元素通常不表现氧化性。
硫酸的物理性质和化学性质:
1.硫酸的物理性质
纯硫酸是无色、黏稠的油状液体,密度大,沸点高,是一种难挥发的强酸,易溶于水,能以任意比与水互溶.浓硫酸溶于水时放出大量的热。常见浓硫酸的质量分数为98.3%,其密度为 1.84g·cm-3,沸点为338℃,物质的量浓度为18.4mol·L-1.H2SO4的浓度越大,密度越大,若将30%的H2SO4溶液与10%的H2SO4溶液等体积混合,所得溶液的质量分数大于20%。
2.稀硫酸的化学性质
稀硫酸具有酸的通性。
(1)与指示剂作用:能使紫色石蕊试液变红。
(2)与碱发生中和反应
(3)与碱性氧化物或碱性气体反应 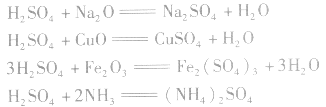
(4)与活泼金属发生置换反应 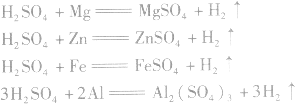
(5)与某些盐溶液反应 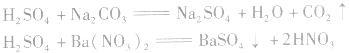
4.浓硫酸的特性
(1)吸水性将一瓶浓硫酸敞口放置在空气中,其质量将增加,密度将减小,浓度降低,体积变大。这是因为浓硫酸具有吸水性,实验室里常利用浓硫酸作干燥剂。
浓硫酸不仅可以吸收空气中的水,还可吸收混在气体中的水蒸气、混在固体中的湿存水、结晶水合物中的部分结晶水。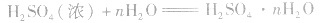 。
。
浓H2SO4中的H2SO4分子可强烈地吸收游离的水分子形成一系列的硫酸水合物: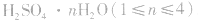 。这些水合物很稳定,所以浓H2SO4可作某些不与其反应的气体、固体的干燥剂,同时不能暴露在空气中。能够用浓H2SO4干燥的气体有
。这些水合物很稳定,所以浓H2SO4可作某些不与其反应的气体、固体的干燥剂,同时不能暴露在空气中。能够用浓H2SO4干燥的气体有 、
、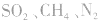 等酸性或中性气体,而具有还原性的气体
等酸性或中性气体,而具有还原性的气体 和碱性气体NH3则不能用浓H2SO4干燥。另外在酯化反应中,如
和碱性气体NH3则不能用浓H2SO4干燥。另外在酯化反应中,如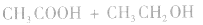
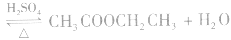 中,浓H2SO4作催化剂和吸水剂。
中,浓H2SO4作催化剂和吸水剂。
(2)脱水性指浓H2SO4将有机物里的氧、氧元素按原子个数比2:1脱去生成水的性质。浓H2SO4从有机物中脱下来的是氢、氧元素的原子,不是水,脱下来的氢、氧元素的原子按2:1的比例结合成H2O;对于分子中所含氢、氧原子个数比为2:l的有机物(如蔗糖、纤维素等),浓H2SO4可使其炭化变黑,如: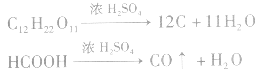
(3)强氧化性常温下,Fe、Al遇浓H2SO4会发生钝化。但热的浓 H2SO4能氧化大多数金属(除金、铂外)、某些非金属单质及一些还原性化合物。如: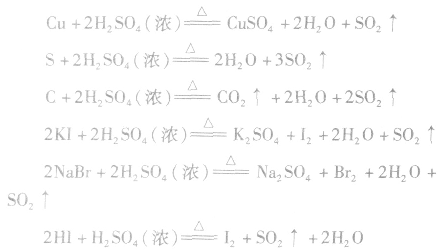
在这些氧化还原反应中,浓硫酸的还原产物一般为SO2。
浓、稀硫酸的比较与鉴别:
1.比较
稀硫酸—弱氧化性—可与活泼金属反应,生成H2—氧化性由H+体现。
浓硫酸——强氧化性——加热时可与绝大多数金属和某些非金属反应,通常生成SO2——氧化性由 体现。
体现。
2.鉴别
从浓H2SO4和稀H2SO4性质的差异人手,可知鉴别浓H2SO4和稀H2SO4的方法有多种。
方法一:取少量蒸馏水,向其中加入少量试样硫酸,如能放出大量热则为浓H2SO4,反之则为稀H2SO4。
方法二:观察状态,浓H2SO4呈黏稠状,而稀H2SO4为黏稠度较小的溶液。
方法三:用手掂掂分量,因为浓H2SO4的密度较大 (1.84g·cm-3,相同体积的浓H2SO4和稀H2SO4,浓H2SO4的质量比稀H2SO4大很多。
方法四:取少量试样,向其中投入铁片,若产生气体,则为稀H2SO4, ;若无明显现象(钝化),则为浓H2SO4。
;若无明显现象(钝化),则为浓H2SO4。
方法五:用玻璃棒蘸取试样在纸上写字,立即变黑 (浓H2SO4的脱水性)者为浓H2SO4,另一种为稀H2SO4。
方法六:取少量试样,分别投入一小块铜片,稍加热发生反应的(有气泡产生)为浓H2SO4。(浓H2SO4的强氧化性),无现象的是稀H2SO4.
硫酸的用途及使用:
(1)用途硫酸是化学工业最黄要的产品之一,它的用途极广(如下图)。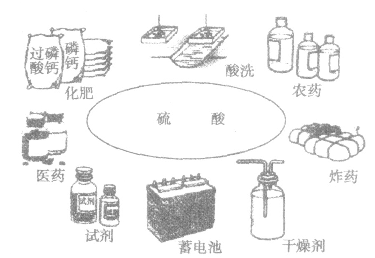
①利用其酸性可制磷肥、氮肥,可除锈,可制实用价值较高的硫酸盐等。
②利用其吸水性,在实验室浓H2SO4常用作干燥剂。
③利用其脱水性,浓H2SO4常作精炼石油的脱水剂、有机反应的脱水剂等。
④利用浓H2SO4的高沸点和难挥发性,常用于制取各种挥发性酸。
⑤浓H2SO4常作有机反应的催化剂。
(2)浓硫酸的安全使用
①浓H2SO4的稀释稀释浓硫酸时应特别注意:将浓硫酸沿器壁慢慢地注入水中,并不断搅拌,使产生的热量迅速地扩散出去。切不可把水倒人浓硫酸里。两种液体混合时,要把密度大的加到密度小的液体中,如浓H2SO4、浓HNO3-混合酸的配制方法是把浓H2SO4沿器壁慢慢地注入浓HNO3中。
②万一不小心将浓硫酸溅到皮肤上、衣服上或桌面上,应分别怎样处理?
皮肤上:用干布迅速拭去,再用大量水冲洗,最后涂上3%~5%的碳酸氢钠溶液。
衣服上:用大量水冲洗。
桌面上:大量时,用适量。NaHCO3,溶液冲洗,后用水冲洗,再用抹布擦干;少量时用抹布擦即可。
(1)焰色反应:Na+:黄色;K+:紫色(透过蓝色钴玻璃观察);Ca2+:砖红色;
(2)H+:H+酸性。遇紫色石蕊试液变红,遇湿润蓝色石蕊试纸变红;
(3)NH4+:在试液中加强碱(NaOH)加热,产生使湿润红色石蕊试纸变蓝的气体;NH4++OH-
 NH3↑+H2O;NH3+H2O
NH3↑+H2O;NH3+H2O NH3?H2O
NH3?H2O NH4++OH-
NH4++OH- (4)Fe3+:①通KSCN或NH4SCN溶液呈血红色:Fe3++SCN-==[Fe(SCN)]2+;②通NaOH溶液红褐色沉淀:Fe3++3OH-==
Fe(OH)3↓
(5)Fe2+:①遇NaOH溶液生成白色沉淀在空气中迅速转化成灰绿色最后变成红褐色沉淀:Fe3++2OH-=Fe(OH)2↓;
4Fe(OH)2+O2+2H2O==4Fe(OH)3;
②试液中加KSCN少量无明显变化再加氯水出现血红色: 2Fe2++Cl2==2Fe3++2Cl-;Fe3++SCN-==[Fe(SCN)]2+
(6)Mg2+:遇NaOH溶液有白色沉淀生成,NaOH过量沉淀不溶解:Mg2++2OH-==Mg(OH)2↓,但该沉淀能溶于NH4Cl溶液;
(7)Al3+:遇NaOH溶液(适量)有白色沉淀生成,NaOH溶液过量沉淀溶解:Al3++3OH-==Al(OH)3↓;Al(OH)3+OH-==
AlO2-+2H2O
(8)Cu2+:遇NaOH溶液有蓝色沉淀生成,加强热变黑色沉淀:Cu2++2OH-==Cu(OH)2↓;Cu(OH)2
 CuO+H2O
CuO+H2O (9)Ba2+:遇稀H2SO4或硫酸盐溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ba2++SO42-==BaSO4↓
(10)Ag+: ①加NaOH溶液生成白色沉淀,此沉淀迅速转变为棕色沉淀溶于氨水Ag++OH-==AgOH↓;2AgOH==Ag2O+H2O;AgOH+2NH3?H2O==[Ag(NO3)2]OH+2H2O
②加稀HCl或可溶性氧化物溶液再加稀HNO3生成白色沉淀:Ag++Cl-==AgCl↓
(11)OH-:OH-碱性:①遇紫色石蕊试液变蓝;②遇酚酞试液变红;③遇湿润红色石蕊试纸变蓝;
(12)Cl-:遇AgNO3溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ag++Cl-=AgCl↓
(13)Br-:加AgNO3溶液有浅黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++Br-=AgBr↓
(14)I-: ①加AgNO3溶液有黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++I-=AgI↓;②加少量新制氯水后再加淀粉溶液显蓝色:2I-+Cl2=I2+2Cl-;I2遇淀粉变蓝
(15)S2-:①加强酸(非强氧化性)生成无色臭鸡蛋气味气体:S2-+2H+=H2S↑;②遇Pb(NO3)2或(CH3COO)2Pb试液生成黑色沉淀,遇CuSO4试液产生黑色沉淀:Pb2++S2-=PbS↓;Cu2++S2-=CuS↓
(16)SO42-:加可溶性钡盐[BaCl2或Ba(NO3)2]溶液有白色沉淀生成后再加稀HCl或稀HNO3沉淀不溶解:Ba2++SO42-=BaSO4↓
(17)SO32-:加强酸(H2SO4或HCl)把产生气体通入品红溶液中,品红溶液褪色:SO32-+2H+=H2O+SO2↑ SO2使品红溶液褪色
(18)CO32-:加稀HCl产生气体通入澄清石灰水,石灰水变浑浊:CO32-+2H+=H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O
(19)HCO3-:取含HCO3-盐溶液煮沸,放出无色无味、使澄清石灰水变浑浊的气体;或向HCO3-溶液里加入稀MgSO4溶液,无现象,加热煮沸有白色沉淀MgCO3生成,同时放出CO2气体。
(20)NO3-:浓缩试液加稀硫酸和铜片加热有红棕色气体产生,溶液变成蓝色:
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
(21)PO43-:加AgNO3溶液产生黄色沉淀,再加稀HNO3沉淀溶解:3Ag++PO43-=Ag3PO4↓;Ag3PO4溶于稀HNO3酸。
与“下列四组实验,根据实验事实得出的结论,正确的是[ ]A.在未...”考查相似的试题有:
- 将按等物质的量的SO2和Cl2混合后的气体溶解于适量的蒸馏水中,再滴入含有品红和Ba(NO3)2的混合溶液,则发生的实验现象是( ...
- 有a、b、c三种常见的短周期元素,它们之间两两结合构成化合物X、Y、Z,X、Y、Z之间也能相互发生反应。已知X是由a和b元素按原...
- 检验SO2中是否混有CO2气体,可采用的方法是( ) A.通过品红溶液 B.先通过NaOH溶液,再通过澄清石灰水 C.通过澄清石灰水 D...
- 某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。(1)①反应开始一段时间后,观察到B、D两个试管...
- 下列有关物质性质或应用的说法正确的是[ ]A.蛋白质水解生成葡萄糖放出热量,提供生命活动的能量B.次氯酸钠具有强还原性,可...
- (12分)某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示的装置进行有关实验。请回答:(1)装置A中发生的化学反应方程式为 ...
- 在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯c中的液体b呈喷泉状喷...
- 现已确认,SO2和NOx的排放是造成酸沉降的两大罪魁祸首。下图表示了某地区在1940~2002年间,空气中SO2和NOx含量因燃料燃烧、工...
- 如图所示,小试管内盛有约3mL饱和硫酸铜溶液,与锥形瓶连通的U形管内盛有少量水(为了便于观察,已染成红色).沿小试管的内...
- A、B、C、D、E、F六种元素,原子序数依次递增,其中A、B、C、D、E均为短周期元素.A元素原子核内无中子;B元素原子最外层电子...