本试题 ““酒是陈的香”的原因之一是储存过程中生成了有香味的酯。实验室用下图所示装置制取乙酸乙酯。(1)试管a中生成乙酸乙酯的化学反应方程式是 。(2)试管b中盛放...” 主要考查您对乙酸乙酯的制备
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 乙酸乙酯的制备
乙酸乙酯的制备:
(1)实验目的:
掌握用醇和羧酸制备酯的方法。
(2)试剂:
乙醇、冰醋酸、浓硫酸、饱和碳酸钠水溶液、饱和食盐水、饱和氯化钙、无水硫酸镁(或无水硫酸钠) 2~3g (用于干燥乙酸乙酯)
(3)反应原理:
主反应: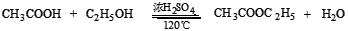
副反应: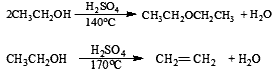
(4)反应装置图:
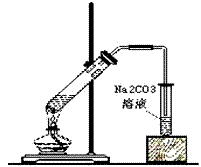
(5)操作步骤
①在一个大试管里注入乙醇2mL,再慢慢加入0.5mL浓硫酸、2mL乙酸,连接好制备乙酸乙酯的装置。
②用小火加热试管里的混合物。把产生的蒸气经导管通到3mL饱和碳酸钠溶液的上方约2mm~3mm处,注意观察盛碳酸钠溶液的试管的变化,待有透明的油状液体浮在液面上,取下盛有碳酸钠溶液的试管,并停止加热。振荡盛有碳酸钠溶液的试管,静置,待溶液分层后,观察上层液体,并闻它的气味。
③加热混合物一段时间后,可看到有气体放出,在盛碳酸钠溶液的试管里有油状物。
(6)注意事项:
1、酯化反应所用仪器必须无水,包括量取乙醇和冰醋酸的量筒也要干燥。
2、加热之前一定将反应混合物混合均匀,否则容易炭化。
3、分液漏斗的正确使用和维护。。
4、用10%碳酸钠水溶液洗涤有机相时有二氧化碳产生,注意及时给分液漏斗放气,以免气体冲开分液漏斗的塞子而损失产品。
5、正确进行蒸馏操作,温度计的位置影响流出温度,温度计水银球的上沿与蒸馏头下沿一平。
6、有机相干燥要彻底,不要把干燥剂转移到蒸馏烧瓶中。
7、反应和蒸馏时不要忘记加沸石。
8、用CaCl2溶液洗之前,一定要先用饱和NaCl溶液洗,否则会产生沉淀,给分液带来困难。
(1)实验目的:
掌握用醇和羧酸制备酯的方法。
(2)试剂:
乙醇、冰醋酸、浓硫酸、饱和碳酸钠水溶液、饱和食盐水、饱和氯化钙、无水硫酸镁(或无水硫酸钠) 2~3g (用于干燥乙酸乙酯)
(3)反应原理:
主反应:
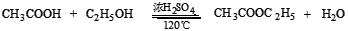
副反应:
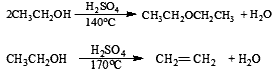
(4)反应装置图:

(5)操作步骤
①在一个大试管里注入乙醇2mL,再慢慢加入0.5mL浓硫酸、2mL乙酸,连接好制备乙酸乙酯的装置。
②用小火加热试管里的混合物。把产生的蒸气经导管通到3mL饱和碳酸钠溶液的上方约2mm~3mm处,注意观察盛碳酸钠溶液的试管的变化,待有透明的油状液体浮在液面上,取下盛有碳酸钠溶液的试管,并停止加热。振荡盛有碳酸钠溶液的试管,静置,待溶液分层后,观察上层液体,并闻它的气味。
③加热混合物一段时间后,可看到有气体放出,在盛碳酸钠溶液的试管里有油状物。
(6)注意事项:
1、酯化反应所用仪器必须无水,包括量取乙醇和冰醋酸的量筒也要干燥。
2、加热之前一定将反应混合物混合均匀,否则容易炭化。
3、分液漏斗的正确使用和维护。。
4、用10%碳酸钠水溶液洗涤有机相时有二氧化碳产生,注意及时给分液漏斗放气,以免气体冲开分液漏斗的塞子而损失产品。
5、正确进行蒸馏操作,温度计的位置影响流出温度,温度计水银球的上沿与蒸馏头下沿一平。
6、有机相干燥要彻底,不要把干燥剂转移到蒸馏烧瓶中。
7、反应和蒸馏时不要忘记加沸石。
8、用CaCl2溶液洗之前,一定要先用饱和NaCl溶液洗,否则会产生沉淀,给分液带来困难。
发现相似题
与““酒是陈的香”的原因之一是储存过程中生成了有香味的酯。实验...”考查相似的试题有:
- 实验室制取乙酸乙酯,如图所示实验装置:请回答下列问题:(1)能完成本实验的装置是______(从甲、乙、丙中选填)(2)试管A...
- 醋酸是重要的一元酸,在有机和无机反应中都有应用.(1)在酯化反应的实验中,乙酸、乙醇的用量和平衡时乙酸乙酯的生成量如下...
- 实验室采用如图所示装置制备乙酸乙酯,实验结束后,取下盛有饱和碳酸钠溶液的试管,再沿该试管内壁缓缓加入石蕊试液1毫升,发...
- 下列说法正确的是( )A.用点燃的方法鉴别甲烷和乙烯B.等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等C.实验室常用...
- Ⅰ.乙酸是生活中常见的有机物之一,乙酸的官能团为______(写名称).用食醋浸泡有水垢(主要成分是CaCO3)的暖瓶或水壶,可...
- 实验室利用下图所示装置制取乙酸乙酯。请回答(1)试管A中盛放的试剂为_____________、乙酸和浓硫酸,它们之间发生反应生成乙...
- 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。已知:(1)制备粗品:将12.5 mL环己醇加入试管A中,再加...
- “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如下图所示的装置制取乙酸乙酯。回答下...
- 已知:①A是一种烃,它的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2催化剂△2CH3COOH.现以A为主要原料合成乙酸乙酯...
- 下列叙述中正确的是( )A.将苯加入浓溴水中,溴水褪色,是因为发生了取代反应B.除去乙酸乙酯中的少量乙酸,可用氢氧化钠溶...