本试题 “下列物质的稀溶液中,溶质的阴、阳离子个数之比为1∶2的是 [ ]A.K2SO4B.Na2CO3C.(NH4)2SO4D.NH4HCO3” 主要考查您对强电解质电离(氯化钠、硫酸氢钠等物质的电离)
盐类水解的定义
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 强电解质电离(氯化钠、硫酸氢钠等物质的电离)
- 盐类水解的定义
强电解质电离:
强电解质在溶液中完全电离,且符号为“=”,如NaCl=Na++Cl-、NaHSO4==Na++H++SO42-
强电解质在溶液中完全电离,且符号为“=”,如NaCl=Na++Cl-、NaHSO4==Na++H++SO42-
酸与碱反应的几种情况:
1.等体积、等物质的量浓度的酸 混合
混合 
2.等体积的酸 混合
混合 
3.若酸 等体积混合溶液呈中性
等体积混合溶液呈中性 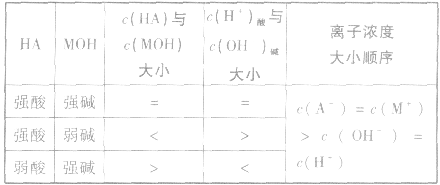
4.强酸溶液(pH=a)与强碱溶液(pH=b)完全中和时的体积比

盐类水解:
1.定义:在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类水解。
2.实质:生成弱电解质,使水的电离平衡被破坏而建立新的平衡。
3.条件:盐中必须有弱酸根离子或弱碱阳离子,盐溶于水。
4.特点:可逆性,写水解离子方程式时要用“ ” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
5.规律:有弱才水解,无弱不水解。谁弱谁水解,谁强显谁性。越弱越水解,都弱都水解。例如:25℃时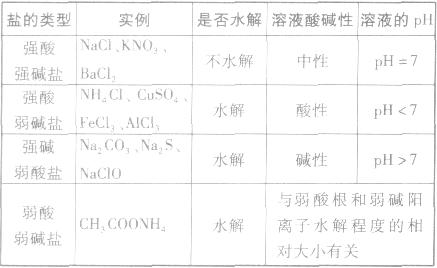
四种重要的动态平衡的比较:
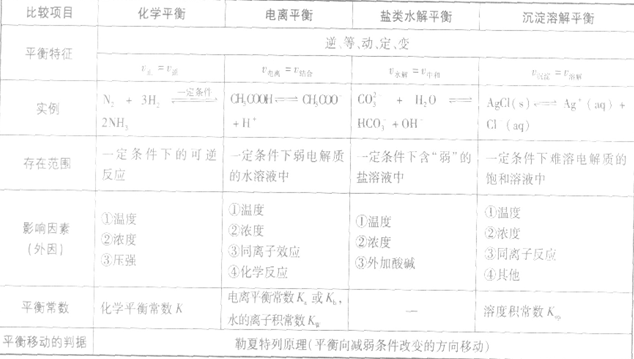
发现相似题
与“下列物质的稀溶液中,溶质的阴、阳离子个数之比为1∶2的是 [ ]...”考查相似的试题有:
- 有五瓶溶液分别是①10毫升0.60摩/升NaOH水溶液 ②20毫升0.50摩/升硫酸水溶液 ③30毫升0.40摩/升HCl溶液 ④40毫升0.30摩/升HAc水溶...
- 废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末 (1)废旧印...
- 某二元弱酸H2A,在溶液中可以发生一级和二级电离:H2AH++HA-,HA-H++A2-,已知相同浓度时H2A比HA-容易电离,在相同温度时下列...
- 下列有关说法正确的是 ( )A.汽车尾气中的一氧化氮遇空气在低温下能自发进行反应,说明该反应的ΔH>0B.纯碱溶于热水中,去油...
- 下列物质的溶液因水解而呈碱性的是A.KHCO3B.Na2OC.NH3·H2OD.KOH
- 下列比较中,正确的是______A.相同条件下,HF比HCN易电离,则NaF溶液的pH比NaCN溶液的大B.0.2mol•L-1NH4Cl和0.1mol•L-1NaOH...
- 欲使0.1 mol·L-1的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减小,其方法是( )A.通入CO2B.加入NaOH固体C.通入HClD.加...
- 下面提到的问题中,与盐的水解无关的正确说法是( )①明矾和FeCl3可作净水剂②为保存FeCl3溶液,要在溶液中加少量盐酸③实验室...
- 等体积的下列溶液中,阳离子总数最多的是()A.0.1mol·L-1的FeCl3溶液B.0.1mol·L-1的AlCl3溶液C.0.05mol·L-1的Na2S溶液D....
- 已知某温度下,K(HCN)= 6.2×10-10mol·L-1、K(HF)= 6.8×10-4mol·L-1、K(CH3COOH)= 1.8×10-5mol·L-1、、K(HNO2)= 6.4×10-6mo...