本试题 “有标准状况下的HCl气体4.48L,其物质的量是______mol,质量是______g,其中含有HCl分子______个,若将这些HCl气体溶于水,制成200ml溶液,其物质的量浓度是__...” 主要考查您对气体摩尔体积
物质的量浓度
物质的量的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 气体摩尔体积
- 物质的量浓度
- 物质的量的有关计算
气体摩尔体积:
单位物质的量的气体所占的体积。
符号:Vm
单位:L/mol(L·mol-1)、m/mol(m·mol-1)
计算公式: 气体摩尔体积(Vm)=气体体积(V)/物质的量(n)
标况下(0℃ 101kPa)气体摩尔体积约为22.4L/mol,在25℃和101kPa条件下,气体摩尔体积约为24.5L/mol。
气体摩尔体积的使用方法:
- 在非标准状况下,不能用气体摩尔体积22.4mol/L进行计算。
- 标准状况下,非气体(即固、液体)不能用气体摩尔体积22.4mol/L进行计算。
- 气体可以是纯净气体,也可以是混合气体。
决定物质体积大小的因素:
- 粒子数目的多少
- 粒子本身的大小
- 粒子之间的平均距离
决定固体、液体物质的体积大小的因素主要是粒子数目的多少和粒子本身的大小;而气体的体积大小的决定因素是粒子数目的多少和分子间的平均距离。
标准状况下,气体摩尔体积的5个“关键”:
- 关键字——气体:研究对象是气体,非气体不研究摩尔体积。
- 关键字——任何:任何气体,只要是气体,不管纯净物还是混合物,只要状态相同,物质的量相同,体积就相同。
- 关键字——标况:标况下气体摩尔体积一定是Vm=22.4L/mol,非标准状况下的气体不一定等于22.4L/mol。
- 关键字——约为:22.4只是个约数,不是准确值,因为对于气体,忽略了粒子的大小对体积的影响,所以在相同的条件下。气体的摩尔体积近似相等。
- 关键字——1mol:气体在标况下的体积约为22.4L所对应的物质的量为1mol。
标准状况:
在0℃和101kPa的条件下,1mol任何气体的体积都约为22.4L。温度为0℃、压强为101kPa时的状况,我们通常称为“标准状况”。
在标准状况下,气体的摩尔体积约为22.4L/mol。
问题探究:
标准状况下,1mol气体的体积是22.4L,如果当1mol气体的体积是22.4L时,一定是标准状况吗?
答:不一定,因为影响气体体积的因素是温度、压强两个条件,非标准状况下1mol气体的体积也可能是22.4L。
物质的量浓度:
定义:单位体积的溶液里所含溶质B的物质的量,也称为B的物质的量浓度
符号:cB
单位:mol/L(mol·L -1)
计算公式:物质的量浓度(cB)=物质的量(n)/溶液的体积(V)
物质的量浓度与溶液质量分数、密度的关系:c=1000ρω/M
稀释定理:
- 稀释前后溶液中溶质的物质的量不变
c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液) - 稀释前后溶液中溶质的质量不变
ρ(浓溶液)V(浓溶液)w%(浓溶液)=ρ(稀溶液)V(稀溶液)w%(稀溶液)
物质的量浓度与质量分数(质量百分比浓度)的比较:
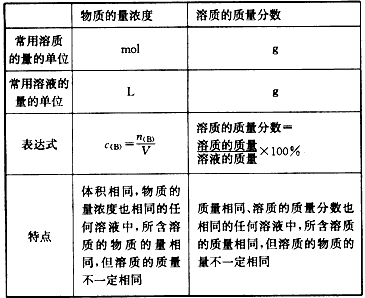
浓度计算的注意事项:
物质的量浓度(cB)=物质的量(n)/溶液的体积(V)
(1)V指溶液体积而不是溶剂的体积;
(2)取出任意体积的1mol/L溶液,其浓度都是1mol/L。但所含溶质的量则因体积不同而不同;
(3)“溶质”是溶液中的溶质,可以是化合物,也可以是离子或气体特定组合,特别的,像NH3、Cl2等物质溶于水后成分复杂,但求算浓度时,仍以溶解前的NH3、Cl2为溶质,如氨水在计算中使用摩尔质量时,用17g/mol。
溶液中溶质的质量分数与溶质的物质的量浓度的换算:
- 溶液中溶质的质量可以用溶质的质量分数表示: m(溶质)=ρ(g·cm-3)·V(L)·w% (1cm3=1mL)
- 溶液中溶质的质量可以用物质的量浓度来表示: m(溶质)=c(mol/L)·V(L)·M(g·mol-1)
- 由于同一溶液中溶质的质量相等,溶液的体积也相等,但注意:1L=1000mL,所以,上述两式可以联系起来:
ρ(g·cm-3)·1000V(mL)·w%=c(mol/L)·V(L)·M(g·mol-1) 化简得:1000ρw%=cM
计算物质的量浓度时应注意的问题:
物质的量浓度是表示溶液组成的一个重要物理量,是高中化学的重要内容之一。应用时要注意以下几方面的问题:
1.注意溶质是什么
对有些特殊情况要注意辨别,不能出错。如SO2、CuSO4·5H2O等溶于水后所得溶液中的溶质分别为 H2SO4和CuSO4,进行有关氨水的浓度计算时以NH3 为溶质来计算等。
2.注意溶液的体积
主要注意两点:一是不能用水的体积代替溶液的体积;二是当题设未给溶液密度时,可将各溶液(一般为稀溶液)的体积相加(如溶液混合、稀释),认为其和为溶液的总体积;当给出密度时,则需通过密度求溶液的最终体积。
3.注意单位运算
在概念理解及应用中,要注意各物理量的单位.一是各物理量的单位要相互匹配,二是从单位运算人手.能简化解题思路,快速求解。
4.注意溶解度的影响
第一,物质的量浓度适用于表示不饱和及饱和溶液中溶质与溶剂的关系,不适用于过饱和溶液(溶质未溶解完全);
第二,注意一些典型问题,如Ca(OH)2的溶解度随温度变化情况及气体物质在溶剂中的溶解问题等。
5.注意密度变化规律
在溶液混合和溶液稀释等问题中,在注意溶液体积变化的同时,还要考虑溶液密度的变化对溶质物质的量浓度的影响。如强酸、强碱、盐等溶液的密度随浓度增大而增大;氨水、乙醇等溶液的密度随浓度增大而减小。
6.注意实验情景
在计算溶液配制或溶液稀释等问题中物质的量浓度时,一要注意不能把水的体积当作溶液的体积;二是配制溶液时,要注意容量瓶规格与所需溶液体积的关系。因容量瓶的规格是固定的,所以选用的容量瓶的规格要等于或略大于所需溶液的体积。
7.注意物质与其组成粒子的关系
物质与其组成粒子的物质的量、物质的量浓度之间的关系可以通过电离方程式进行分析。如Na2SO4 溶液中c(Na+)=2c(SO42-)=2c(Na2SO4)。
以物质的量为核心的演绎公式:
1.溶液稀释定律
(1)对于已知质量分数溶液的稀释:稀释前后溶质的质量不变,即: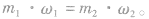
(2)对于已知物质的量浓度溶液的稀释:稀释前后溶质的物质的量不变,即: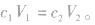
2.物质的量浓度与溶质质量分数的换算
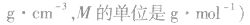
3.溶解度S与溶质质量分数ω的换算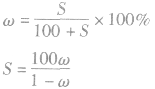
4.溶解度与饱和溶液物质的量浓度的换算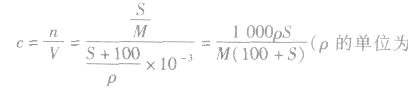

5.标准状况下气体溶于水后所得溶液的物质的量浓度的计算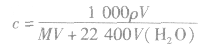
式中V为标准状况下气体的体积(L),V(H2O)为水的体积(L),ρ为溶液的密度(g·cm-3)。
6.相对密度(D)的计算及意义两种气体在同温同压下的密度之比即为相对密度,显然,它等于相对分子质量(或摩尔质量)之比,即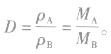
与“有标准状况下的HCl气体4.48L,其物质的量是______mol,质量是...”考查相似的试题有:
- 下列叙述中,错误的是[ ]A.在标准状况下,气体的摩尔体积约为22.4 L·rnol-1B.在标准状况下,0.3 mol H2与0.7 mol N2组成...
- (A类)某混合溶液中所含离子的浓度如下表,则Mn+离子及a值可能为( )所含离子NO-3SO2-4H+Na+Mn+浓度(mol•L-1)3121aA.Fe2...
- 0.5L 1mol/L FeCl3溶液与0.2L 1mol/L KCl溶液中的Cl-的物质的量浓度之比( )A.5:2B.3:1C.15:2D.1:3
- 0.3molNaCl固体溶于水配成200mL溶液,溶液浓度为( )A.0.3mol•L-1B.0.15 mol•L-1C.1.5 mol•L-1D.0.015 mol•L-1
- 在100mL的溶液中溶有0.1molNaCl和0.1molMgCl2,此溶液中Cl-的物质的量浓度为( )A.3mol•L-1B.2mol•L-1C.0.3mol•L-1D.0.2...
- 下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是[ ]A.该硫酸的物质的量浓度为9.2 m...
- 镁、铝合金3g与100mL稀H2SO4恰好完全反应,将反应后所得溶液蒸干,得无水硫酸盐17.4g,则原硫酸溶液的物质的量浓度为( )A....
- 现用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4500mL(1)所用浓硫酸的物质的量浓度为______mol/L.(2)所需浓H2S...
- (1)等体积的NaCl、MgCl2、AlCl3三种溶液分别与等体积等物质和量浓度的AgNO3溶液恰好完全反应,则NaCl、MgCl2、AlCl3三种溶...
- 已知在标况下的四种气体 ①6.72L CH4②3.01×1023个HCl分子 ③1•6gH2④0.2molNH3用相应的序号填写下列空白:(1)物质的量最大的...