本试题 “将混有炭粉的铜粉在空气中充分加热后,最终得到黑色物质,其质量与原混合物的质量相等.则炭粉在原混合物中的质量分数是( )A.15.8%B.20%C.80%D.84.2%” 主要考查您对物质组成元素的质量分数
碳的性质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 物质组成元素的质量分数
- 碳的性质
定义:
物质中某元素的质量分数,就是该元素的质量与组成物质的各元素总质量之比。
公式:
某元素的质量分数=
如AmBn中A元素的质量分数=
若题目给出物质的化学式,又同时知道物质的实际质量,则可根据物质的质量×某元素的质量分数=该元素的质量,将其中所含元素的质量求出。同理,物质的质量=某元素质量÷该元素的质量分数。
公式的理解:
计算时应先列式计算,然后代入数据算出结果。如水中氢元素的质量分数=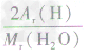 ×100%=
×100%=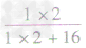 ×100%=
×100%=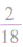 ×100%=11.1%而不能写成
×100%=11.1%而不能写成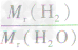 ×100%=
×100%=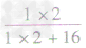 ×100%=
×100%=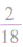 ×100%=11.1%
×100%=11.1%
化学式中质量分数的应用:
①已知物质的质量求所含的某元素的质量
利用公式:元素的质量=物质的质量×该元素的质量分数
②已知元素的质量求物质的质量
利用公式:物质的质量=元素的质量÷该元素的质量分数
③根据元素的质量分数确定物质的化学式
利用化学式的变形比较元素质量分数的大小:
例: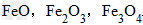 三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?
三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?
解析:三种含铁的氧化物的化学式可变形为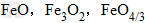 ,则三种含铁的氧化物中铁元素的质量分数分别为:
,则三种含铁的氧化物中铁元素的质量分数分别为: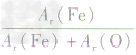 、
、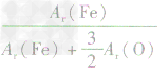 、
、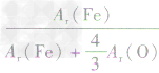 ,通过比较分母可知:
,通过比较分母可知: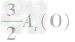 >
>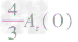 >Ar(O),故铁元素的质量分数由大到小排列的顺序为
>Ar(O),故铁元素的质量分数由大到小排列的顺序为 。
。
物质中某元素的质量分数,就是该元素的质量与组成物质的各元素总质量之比。
公式:
某元素的质量分数=

如AmBn中A元素的质量分数=

若题目给出物质的化学式,又同时知道物质的实际质量,则可根据物质的质量×某元素的质量分数=该元素的质量,将其中所含元素的质量求出。同理,物质的质量=某元素质量÷该元素的质量分数。
公式的理解:
计算时应先列式计算,然后代入数据算出结果。如水中氢元素的质量分数=
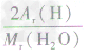 ×100%=
×100%=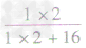 ×100%=
×100%=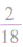 ×100%=11.1%而不能写成
×100%=11.1%而不能写成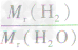 ×100%=
×100%=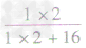 ×100%=
×100%=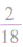 ×100%=11.1%
×100%=11.1%化学式中质量分数的应用:
①已知物质的质量求所含的某元素的质量
利用公式:元素的质量=物质的质量×该元素的质量分数
②已知元素的质量求物质的质量
利用公式:物质的质量=元素的质量÷该元素的质量分数
③根据元素的质量分数确定物质的化学式
利用化学式的变形比较元素质量分数的大小:
例:
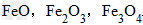 三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?
三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?解析:三种含铁的氧化物的化学式可变形为
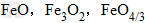 ,则三种含铁的氧化物中铁元素的质量分数分别为:
,则三种含铁的氧化物中铁元素的质量分数分别为: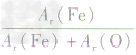 、
、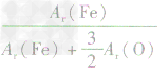 、
、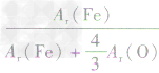 ,通过比较分母可知:
,通过比较分母可知: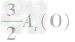 >
>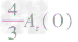 >Ar(O),故铁元素的质量分数由大到小排列的顺序为
>Ar(O),故铁元素的质量分数由大到小排列的顺序为 。
。概述:
碳是一种非金属元素,位于元素周期表的第二周期IVA族。拉丁语为Carbonium,意为“煤,木炭”。汉字“碳”字由木炭的“炭”字加石字旁构成,从“炭”字音。碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳之中。碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。碳是生铁、熟铁和钢的成分之一。碳能在化学上自我结合而形成大量化合物,在生物上和商业上是重要的分子。生物体内大多数分子都含有碳元素。
碳的存在形式:
碳的存在形式是多种多样的,有晶态单质碳如金刚石、石墨;有无定形碳如煤;有复杂的有机化合物如动植物等;碳酸盐如大理石等。单质碳的物理和化学性质取决于它的晶体结构。高硬度的金刚石和柔软滑腻的石墨晶体结构不同,各有各的外观、密度、熔点等。
碳的化学性质:
1.稳定性:在常温下碳的化学性质稳定,点燃或高温的条件下能发生化学反应
2.可燃性:
氧气充足的条件下:C+O2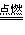 CO2
CO2
氧气不充分的条件下:2C+O2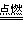 2CO
2CO
3.还原性:
木炭还原氧化铜:C+2CuO 2Cu+CO2↑
2Cu+CO2↑
焦炭还原氧化铁:3C+2Fe2O3 4Fe+3CO2↑
4Fe+3CO2↑
焦炭还原四氧化三铁:2C+Fe3O4 3Fe+2CO2↑
3Fe+2CO2↑
木炭与二氧化碳的反应:C+CO2 CO
CO
碳”与“炭”的区别:
“碳”是一种核电荷数为6的非金属元素,而“炭” 一般是指由石墨的微小晶体和少量杂质组成的混合物,如木炭、焦炭、活性炭、炭黑等。在说明碳元素时,用“碳”表示,如碳单质、二氧化碳、碳酸等;在说明含石墨的无定形碳时,用“炭”表示,如木炭、焦炭等。
碳燃烧生成物的判断:
氧气量充足时,碳充分燃烧:C+O2 CO2
CO2
氧气量不充足时,碳不充分燃烧:2C+O2 2CO
2CO
mg碳与ng氧气反应:
①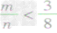 时,生成物只有CO,且O2有剩余;
时,生成物只有CO,且O2有剩余;
②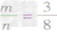 时,恰好完全反应生成CO2;
时,恰好完全反应生成CO2;
③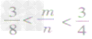 时,生成物既有CO2,也有CO;
时,生成物既有CO2,也有CO;
④ 时,恰好完全反应生成CO;
时,恰好完全反应生成CO;
⑤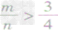 时,生成物只有CO,且C有剩余。
时,生成物只有CO,且C有剩余。
碳单质及其化合物间的转化:
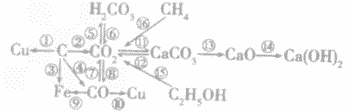
(1)C+2CuO 2Cu+CO2↑
2Cu+CO2↑
(2)C+O2 CO2
CO2
(3)3C+2Fe2O3 4Fe+3CO2↑
4Fe+3CO2↑
(4)2C+O2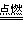 2CO
2CO
(5)CO2 + H2O===H2CO3
(6)H2CO3==CO2 + H2O
(7)2CO + O2 2CO2
2CO2
(8)C+CO2 2CO
2CO
(9)3CO + Fe2O3 2Fe + 3CO2
2Fe + 3CO2
(10)CO+ 2CuO 2Cu + CO2
2Cu + CO2
(11)Ca(OH)2 + CO2====CaCO3↓+ H2O
(12)CaCO3+2HCl==CaCl2+CO2↑+H2O
(13)CaCO3 CaO+CO2
CaO+CO2
(14)CaO+H2O==Ca(OH)2
(15)C2H5OH+3O2 2CO2+3H2O
2CO2+3H2O
(16)CH4+O2 CO2+2H2O
CO2+2H2O
碳是一种非金属元素,位于元素周期表的第二周期IVA族。拉丁语为Carbonium,意为“煤,木炭”。汉字“碳”字由木炭的“炭”字加石字旁构成,从“炭”字音。碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳之中。碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。碳是生铁、熟铁和钢的成分之一。碳能在化学上自我结合而形成大量化合物,在生物上和商业上是重要的分子。生物体内大多数分子都含有碳元素。
碳的存在形式:
碳的存在形式是多种多样的,有晶态单质碳如金刚石、石墨;有无定形碳如煤;有复杂的有机化合物如动植物等;碳酸盐如大理石等。单质碳的物理和化学性质取决于它的晶体结构。高硬度的金刚石和柔软滑腻的石墨晶体结构不同,各有各的外观、密度、熔点等。
碳的化学性质:
1.稳定性:在常温下碳的化学性质稳定,点燃或高温的条件下能发生化学反应
2.可燃性:
氧气充足的条件下:C+O2
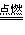 CO2
CO2 氧气不充分的条件下:2C+O2
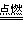 2CO
2CO 3.还原性:
木炭还原氧化铜:C+2CuO
 2Cu+CO2↑
2Cu+CO2↑ 焦炭还原氧化铁:3C+2Fe2O3
 4Fe+3CO2↑
4Fe+3CO2↑ 焦炭还原四氧化三铁:2C+Fe3O4
 3Fe+2CO2↑
3Fe+2CO2↑ 木炭与二氧化碳的反应:C+CO2
 CO
CO 碳”与“炭”的区别:
“碳”是一种核电荷数为6的非金属元素,而“炭” 一般是指由石墨的微小晶体和少量杂质组成的混合物,如木炭、焦炭、活性炭、炭黑等。在说明碳元素时,用“碳”表示,如碳单质、二氧化碳、碳酸等;在说明含石墨的无定形碳时,用“炭”表示,如木炭、焦炭等。
碳燃烧生成物的判断:
氧气量充足时,碳充分燃烧:C+O2
 CO2
CO2 氧气量不充足时,碳不充分燃烧:2C+O2
 2CO
2CO mg碳与ng氧气反应:
①
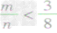 时,生成物只有CO,且O2有剩余;
时,生成物只有CO,且O2有剩余;②
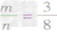 时,恰好完全反应生成CO2;
时,恰好完全反应生成CO2; ③
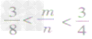 时,生成物既有CO2,也有CO;
时,生成物既有CO2,也有CO;④
 时,恰好完全反应生成CO;
时,恰好完全反应生成CO; ⑤
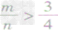 时,生成物只有CO,且C有剩余。
时,生成物只有CO,且C有剩余。 碳单质及其化合物间的转化:

(1)C+2CuO
 2Cu+CO2↑
2Cu+CO2↑ (2)C+O2
 CO2
CO2(3)3C+2Fe2O3
 4Fe+3CO2↑
4Fe+3CO2↑ (4)2C+O2
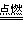 2CO
2CO (5)CO2 + H2O===H2CO3
(6)H2CO3==CO2 + H2O
(7)2CO + O2
 2CO2
2CO2 (8)C+CO2
 2CO
2CO(9)3CO + Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 (10)CO+ 2CuO
 2Cu + CO2
2Cu + CO2 (11)Ca(OH)2 + CO2====CaCO3↓+ H2O
(12)CaCO3+2HCl==CaCl2+CO2↑+H2O
(13)CaCO3
 CaO+CO2
CaO+CO2 (14)CaO+H2O==Ca(OH)2
(15)C2H5OH+3O2
 2CO2+3H2O
2CO2+3H2O(16)CH4+O2
 CO2+2H2O
CO2+2H2O 发现相似题
与“将混有炭粉的铜粉在空气中充分加热后,最终得到黑色物质,其...”考查相似的试题有:
- 食用加碘盐是为了防止碘缺乏症.某加碘食盐配料及说明如下,以下推断中正确的是( )成分含量食用方法氯化钠(NaCl)≥98.0%(...
- 化学与人类生活的关系越来越密切.(1)我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等,用灼烧法可初步鉴...
- 乙烯(C2H4)产量是衡量一个国家石油化工发展水平的一个重要标志。下列有机物含碳元素的质量分数与乙烯相同的是[ ]A.CH4B.C2H2C...
- )维生素C(化学式为C6H8O6)对人体的健康有重要作用。经研究表明,青少年每天都需要摄入60mg的维生素C,若其中的12mg由水果补...
- 某金属氧化物R在氧化物里显+2价,其氧化物中,R的质量分数为80%,则该氧化物的相对分子质量为______.
- 葡萄糖能给我们带来甜蜜和健康,它是生产生活中一种常见的有机物,分子式C6H12O6下列有关说法错误的是( )A.葡萄糖的相对分...
- (1)“神七”载人飞船所用固体燃料是铝粉和高氯酸铵的混合物.发射时,点燃铝粉产生大量的热引发高氯酸铵发生如下反应:2NH4Cl...
- 碳纳米管(如图所示)是一种由六角网状的石墨烯片卷成的具有螺旋周期管状结构,虽然与高分子材料的结构相似,但其结构却比高...
- 下列对一些事实的解释错误的是( )事实解释A书写档案规定必须使用碳素墨水碳的化学性质稳定B石墨能够做电池的电极材料 石墨...
- 科学家最近发现,碳70在一定条件下吸收可见光后可高效杀灭癌细胞,有望成为癌症治疗药物的候选原料。C70分子呈橄榄球状。下列...