本试题 “常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。下列叙述正确的是A.HA为...” 主要考查您对水的离子积常数
水电离的影响因素
水的电离平衡
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 水的离子积常数
- 水电离的影响因素
- 水的电离平衡
水的电离:
水是一种极弱的电解质,它能微弱地电离:
实验测得:25℃时,1L纯水中只有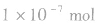 的水分子发生电离,故25℃时纯水中
的水分子发生电离,故25℃时纯水中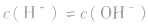

水的离子积:
在一定温度下,水电离出的c(H+)与c(OH-)的乘积是一个常数,称为水的离子积常数,简称水的离子积,用符号 表示,即
表示,即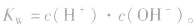
(1)在一定温度下,水的离子积都是一个常数,在25℃时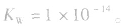
(2)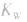 随温度的变化而变化,温度升高,
随温度的变化而变化,温度升高,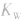 增大。
增大。
(3)水的离子积常数揭示了在任何水溶液中均存在水的电离平衡,都有 存在。在酸性或碱性的稀溶液中,当温度为25℃时,
存在。在酸性或碱性的稀溶液中,当温度为25℃时,
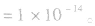
(4)在酸或碱的稀溶液中,由水电离出的c(H+)和c(OH-)总相等.即 如25℃时
如25℃时 或NaOH溶液中,
或NaOH溶液中,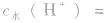
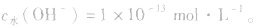
溶液中c(H+)或c(OH-)的计算:
常温下,稀溶液中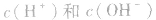 的乘积总是
的乘积总是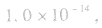 知道
知道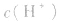 就可以计算出
就可以计算出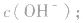 反之亦然
反之亦然
1.酸溶液
当在水中加入酸后,将使水的电离平衡向左移动 (抑制水的电离)。在酸的水溶液中,H+主要由酸电离产生,即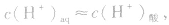 而OH-是由水电离产生的:
而OH-是由水电离产生的: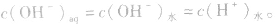
2.碱溶液
同理,在碱的水溶液中,OH-主要由碱电离产生,即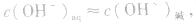 而H+是由水电离产生的:
而H+是由水电离产生的: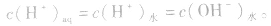
3.盐溶液
在盐的水溶液中,H+和OH-全部来自水的电离,且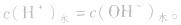
(1)若单一水解的盐的水溶液呈酸性,c(H+)> c(OH-),即弱碱阳离子水解


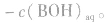
(2)若单一水解的盐的水溶液呈碱性,c(OH一)> c(H+),即弱酸阴离子水解
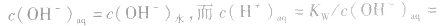
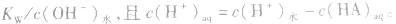
说明:由以上分析可以看出,在常温下(25℃):
酸(或碱)的溶液中,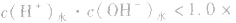
 发生水解的盐溶液中
发生水解的盐溶液中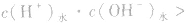
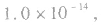 但
但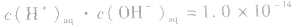 总成立。
总成立。
影响水电离平衡的因素:
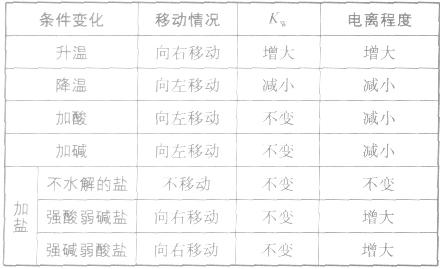
水的电离:
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O
 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L 注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
发现相似题
与“常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-...”考查相似的试题有:
- (8分)A、B代表不同物质,都是H、N、O三种元素组成的强电解质,A、B的水溶液都呈酸性,且相同浓度时,A溶液抑制水的电离,B溶...
- 在Na2S溶液中存在的下列关系不正确的是( )A.=2[++]B.+=++C.=++2D.>>>
- 25 ℃时,在等体积的①pH=0的H2SO4溶液,②0.05 mol·L-1的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的...
- 中和相同体积、相同pH的Ba(OH)2、NaOH和NH3·H2O三种稀溶液,所用相同浓度的盐酸的体积分别为V1、V2、V3,则三者的大小关系为( )...
- 某温度时,水的Kw=1.0×10-12。则在该温度时,PH=7的溶液()A.呈碱性B.呈中性C.呈酸性D.无法确定
- 人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程。我们目前中学课本中的酸碱理论是1887年...
- A、B、C三种物质都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈中性,B的水溶液呈碱性,C的水溶液呈酸性,请找...
- 已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示(1)则25 ℃时,水的电离平衡曲线应为__________(填“A”或“B”),请说明理由______...
- 已知:常温下,A酸的溶液pH=a,B碱的溶液pH=b。(1)若A为盐酸,B为氢氧化钠,且a+b=14,二者等体积混合,则溶液的pH=___...
- ⑴有一学生在实验室测某溶液pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。①这种错误操作 (...