本试题 “铜的冶炼过程大致可分为:①富集,将硫化物矿进行浮选;②焙烧,主要反应为:2CuFeS2+4O2===Cu2S+3SO2+2FeO(炉渣);③制粗铜,在1200℃发生的主要反应为:2Cu2...” 主要考查您对电解精炼铜
金属的冶炼
电化学有关的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电解精炼铜
- 金属的冶炼
- 电化学有关的计算
精炼铜:
(1)要求
(2)反应原理如下图所示: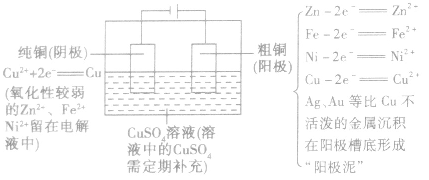
金属的冶炼:
(1)把金属从化合态变为游离态。常用冶炼法:用碳一氧化碳氢气等还原剂与金属氧化物在高温下反应。
(2)冶炼的原理
①还原法:金属氧化物(与还原剂共热)--→游离态金属
②置换法:金属盐溶液(加入活泼金属)--→游离态金属
③火法冶炼(Pyrometallurgy)又称为干式冶金,把矿石和必要的添加物一起在炉中加热至高温,熔化为液体,生成所需的化学反应,从而分离出粗金属,然后再将粗金属精炼。
④湿式冶金(Hydrometallurgy) 湿法冶金这种冶金过程是用酸、碱、盐类的水溶液,以化学方法从矿石中提取所需金属组分,然后用水溶液电解等各种方法制取金属。此法主要应用在低本位、难熔化或微粉状的矿石。现在世界上有75%的锌和镉是采用焙烧-浸取-水溶液电解法制成的。这种方法已大部分代替了过去的火法炼锌。其他难于分离的金属如镍-钴,锆-铪,钽-铌及稀土金属都采用湿法冶金的技术如溶剂萃取或离子交换等新方法进行分离,取得显著的效果。
(3)常见金属冶炼:
①汞:热分解法:2HgO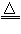 2Hg+O2(气体)
2Hg+O2(气体)
②铜:置换法:CuSO4+Fe==Cu+FeSO4(又叫湿法炼铜)
③铝:电解法:2Al2O3 4Al+3O2(注意不能用AlCl3,因为AlCl3不是离子化合物)
4Al+3O2(注意不能用AlCl3,因为AlCl3不是离子化合物)
④镁:电解法:MgCl2(l) Mg(s)+Cl2(g)↑
Mg(s)+Cl2(g)↑
⑤钠:电解法:2NaCl 2Na+Cl2↑
2Na+Cl2↑
⑥钾:原理是高沸点金属制低沸点金属:Na+KCl==K+NaCl(反应条件是高温,真空。)
⑦铁:热还原法:2Fe2O3+3C 2Fe+3CO2↑
2Fe+3CO2↑
(1)把金属从化合态变为游离态。常用冶炼法:用碳一氧化碳氢气等还原剂与金属氧化物在高温下反应。
(2)冶炼的原理
①还原法:金属氧化物(与还原剂共热)--→游离态金属
②置换法:金属盐溶液(加入活泼金属)--→游离态金属
③火法冶炼(Pyrometallurgy)又称为干式冶金,把矿石和必要的添加物一起在炉中加热至高温,熔化为液体,生成所需的化学反应,从而分离出粗金属,然后再将粗金属精炼。
④湿式冶金(Hydrometallurgy) 湿法冶金这种冶金过程是用酸、碱、盐类的水溶液,以化学方法从矿石中提取所需金属组分,然后用水溶液电解等各种方法制取金属。此法主要应用在低本位、难熔化或微粉状的矿石。现在世界上有75%的锌和镉是采用焙烧-浸取-水溶液电解法制成的。这种方法已大部分代替了过去的火法炼锌。其他难于分离的金属如镍-钴,锆-铪,钽-铌及稀土金属都采用湿法冶金的技术如溶剂萃取或离子交换等新方法进行分离,取得显著的效果。
(3)常见金属冶炼:
①汞:热分解法:2HgO
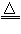 2Hg+O2(气体)
2Hg+O2(气体) ②铜:置换法:CuSO4+Fe==Cu+FeSO4(又叫湿法炼铜)
③铝:电解法:2Al2O3
 4Al+3O2(注意不能用AlCl3,因为AlCl3不是离子化合物)
4Al+3O2(注意不能用AlCl3,因为AlCl3不是离子化合物)④镁:电解法:MgCl2(l)
 Mg(s)+Cl2(g)↑
Mg(s)+Cl2(g)↑ ⑤钠:电解法:2NaCl
 2Na+Cl2↑
2Na+Cl2↑ ⑥钾:原理是高沸点金属制低沸点金属:Na+KCl==K+NaCl(反应条件是高温,真空。)
⑦铁:热还原法:2Fe2O3+3C
 2Fe+3CO2↑
2Fe+3CO2↑ 炼铁和炼钢的比较:
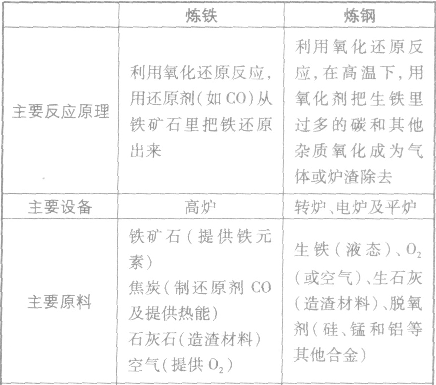

铝的冶炼:
(1)由铝土矿制氧化铝
①将铝土矿中的氧化铝水合物溶解在氢氧化钠溶液中: 
②向偏铝酸钠溶液中通入二氧化碳,析出氢氧化铝: 
③使氢氧化铝脱水生成氧化铝:
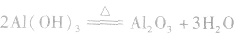
(2)电解氧化铝制备铝
电解时,以氧化铝、冰晶石(Na2AlF6)熔融液为电解质,其中也常加入少量的氟化钙等帮助降低熔点;阳极和阴极以碳素材料做成,在电解槽的钢板和阴极碳素材料之间还要放置耐火绝缘材料。
①主要设备——电解槽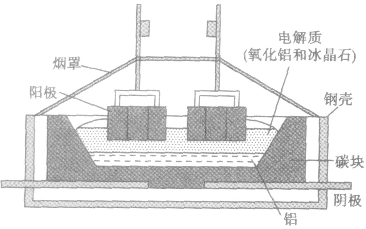
②电极反应式
阳极反应: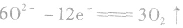
阴极反应: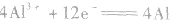
总反应:
电化学计算的基本方法和技巧:
原电池和电解池的计算包括两极产物的定量计算、溶液的pH计算、相对原子质量的计算,根据电量求产物的量或根据产物的量求电量等。通常有下列三种方法。
1.根据电子守恒法
计算用于串联电路中阴、阳两极产物或正、负两极产物的量的计算,其依据是电路中转移的电子数相等。
2.根据总反应式计算
先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算。
3.根据关系式计算
运用得失电子守恒建立已知量与未知量之间的关系式。如以通过4mole一为桥梁可构建电极产物之间的如下关系式: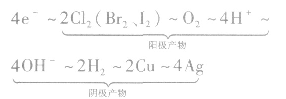
该关系式具有总揽电化学计算的作用和价值,熟记电极反应式,灵活运用这个关系式便能快速解答常见的电化学计算问题。
特别提醒:在电化学计算中,还常利用 和
和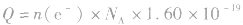 来计算电路中通过的电量。
来计算电路中通过的电量。
发现相似题
与“铜的冶炼过程大致可分为:①富集,将硫化物矿进行浮选;②焙烧...”考查相似的试题有:
- 电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以...
- (1)氢氧燃料电池以熔融态的碳酸盐为电解质,其中CO2会参与电极反应。工作时负极的电极反应为;正极的电极反应为___________...
- 下列各种冶炼方法中,可制得相应金属的是[ ]A.加热Al2O3B.加热CaCO3C.电解熔融NaClD.氯化钠与铝粉高温共热
- 把物质的量均为0.1mol的AlCl3、CuCl2和H2SO4溶于水制成100ml的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段...
- 按下图装置进行实验,并回答下列问题(1)判断装置的名称:A池为___________ B池为___________(2)铁极为__________极,电极...
- 已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO42H2O+2PbSO4;镍镉碱性充电电池在放电时,其正极反应为:2NiO(OH)+2H2O+2e-...
- 下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极...
- 由等质量的锌片、铜片组成的Zn-Cu-H2SO4原电池,工作一段时间后,锌片的质量减少了2.6g。求:(1)生成氢气的体积(标准状况...
- 下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH ==2K2CO3+6H2O(1)请回答图中甲、乙两池的名称。甲池...
- 将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为[ ]...