本试题 “进行下列反应后,所得溶液中一定只含一种溶质的是[ ]A.Fe3O4溶于适量的稀盐酸中B. 向MgSO4、H2SO4的混合溶液中加入过量的氢氢化钡溶液C.向NaOH溶液中滴入...” 主要考查您对铝盐(铝离子)
四氧化三铁
乙酸
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 铝盐(铝离子)
- 四氧化三铁
- 乙酸
铝盐:
铝盐是指正三价铝离子和酸根阴离子组成的盐,一般来说呈白色或无色晶体,溶于水,个别不溶于水。
常用的铝盐主要有三氯化铝、硫酸铝和明矾。
(1)与碱反应:Al3++3OH-(少量)==Al(OH)3↓
Al3++4OH-(过量)== AlO2-+2H2O
(2)Al3++3AlO2-+6H2O==4Al(OH)3↓
铝盐的性质:
Al3+易水解,显酸性Al3++3H2O==Al(OH)3+3H+
(1)与碱反应:Al3++3OH-(少量)==Al(OH)3↓
Al3++4OH-(过量)==AlO2-+2H2O
(2)易发生双水解:Al3++3AlO2-+6H2O==4Al(OH)3↓
铝盐与强碱溶液作用生成Al(OH)3沉淀的计算
反应关系如下:
(1)Al3++3OH-==Al(OH)3(生成沉淀)
(2)Al(OH)3+OH-==AlO2-+2H2O(沉淀溶解)
(3)Al3++4OH-==AlO2-+2H2O(生成沉淀,又恰好溶解)
分析以上三个化学反应方程式,所得Al(OH)3沉淀的物质的量与n(Al3+)、n(OH-)的关系为:
当 ≤3时,所得沉淀的物质的量:n[Al(OH)3]=
≤3时,所得沉淀的物质的量:n[Al(OH)3]=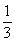 n(OH-)
n(OH-)
当 ≥4时,所得沉淀的物质的量:n[Al(OH)3]=0
≥4时,所得沉淀的物质的量:n[Al(OH)3]=0
当3< <4时,所得沉淀的物质的量:n[Al(OH)3]=4n(Al3+)-n(OH-)
<4时,所得沉淀的物质的量:n[Al(OH)3]=4n(Al3+)-n(OH-)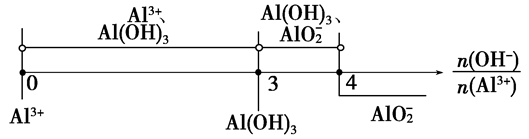
2、有关Al(OH)3的图像分析
①向 溶液中滴加
溶液中滴加 溶液
溶液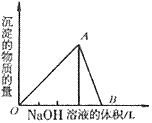
O~A段: 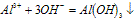
A~B段: 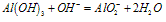
②向强碱溶液中滴入铝盐溶液 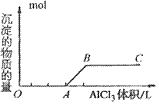
O~A段: 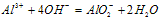
A~B段: 
③向铝盐溶液中滴入氨水或向氨水中滴加铝盐溶液
A. 向铝盐中滴加氨水时,当氨水增加到 时,产生最大沉淀量
时,产生最大沉淀量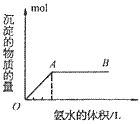
B. 向氨水中滴加铝盐溶液时,开始时氨水过量,如图所示 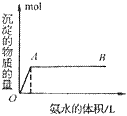
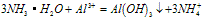
分析得:氢氧化铝不溶于弱碱氨水中。
④向偏铝酸盐溶液中滴入强酸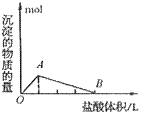
O~A段:
O~B段: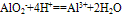
⑤向盐酸中滴加偏铝酸盐溶液 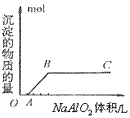
O~A段: 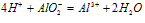
A~B段: 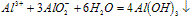
“铝三角”关系:
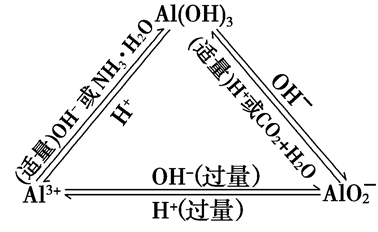
Al3++3OH-===Al(OH)3↓
Al(OH)3+OH-===AlO2-+2H2O
Al3++4OH-===AlO2-+2H2O
AlO2-+2H2O+CO2===Al(OH)3↓+HCO3-
AlO2-+H++H2O===Al(OH)3↓
AlO2-+4H+===Al3++2H2O
典型例题解析:
在50mLbmol·L-1的AlCl3溶液中加入50mLamol·L-1NaOH溶液。
(1)当a≤3b时,生成Al(OH)3沉淀的物质的量为________。
(2)当a、b满足________条件时,无沉淀产生。
(3)当a、b满足________条件时,先有沉淀生成,后又有部分沉淀溶解,此时Al(OH)3的质量为________g。
解析:依题意知,在AlCl3溶液中加入NaOH溶液有如下两个反应发生: AlCl3+3NaOH===Al(OH)3↓+3NaCl ①
AlCl3+4NaOH===NaAlO2+3NaCl+2H2O ②
根据以上两反应可以看出:
(1)当a≤3b时,只发生第一个反应,此时NaOH不足量,产生沉淀的量取决于NaOH。3n[Al(OH)3]=n(NaOH)?。所以答案为0.05a/3mol。
(2)如果无沉淀生成,Al元素全部以AlO2-形式存在。 n(AlCl3)∶n(NaOH)≤1∶4,即a∶b≥4∶1,所以答案为a≥4b。
(3)此种情况应当是两个反应均发生,铝元素以Al(OH)3和AlO2-两种形式存在。符合关系: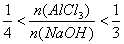 即
即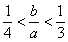 ,整理得:3b<a<4b或
,整理得:3b<a<4b或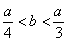 。
。
求沉淀的量的方法很多。
解法一:联立方程法。
设反应①中,AlCl3物质的量为x,则Al(OH)3为x,NaOH为3x。
反应②中AlCl3物质的量为y,NaOH为4y。 
解得x=(0.2b-0.05a)mol=0.05(4b-a)mol。 m[Al(OH)3]=78g·mol-1×0.05(4b-a)mol=3.9(4b-a)g。
解法二:守恒法。此种条件下,溶液中的离子有Na+、Cl-、AlO2-。
n(AlO2-)=n(Na+)-n(Cl-)=0.05amol-0.05×3bmol。
n[Al(OH)3]=n(Al3+)总-n(AlO2-)=0.05bmol-(0.05amol-0.15bmol)=(0.2b-0.05a)mol=0.05(4b-a)mol。
m[Al(OH)3]=78g·mol-1×0.05(4b-a)mol =3.9(4b-a)g。
【答案】 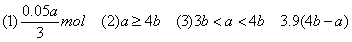
四氧化三铁:
又称磁性氧化铁,具有磁性的黑色晶体,不溶于水,具有优良的导电性。
四氧化三铁的性质:
(1)色态:具有磁性的黑色晶体
(2)别名:磁性氧化铁、氧化铁黑、磁铁、磁石、吸铁石、偏铁酸亚铁
(3)矿物:磁铁矿
(4)溶解性:不溶于水,与酸反应生成+2、+3铁盐
(5)稳定性:稳定
(6)还原性:在高温下,易氧化成三氧化二铁。4Fe3O4+O2 6Fe2O3
6Fe2O3
(7)氧化性:在高温下可与还原剂H2、CO、Al、C等反应。 


铁的氧化物:
| 化学式 | FeO | Fe2O3 | Fe3O4 |
| 俗称 | —— | 铁红 | 磁性氧化铁 |
| 色态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 铁的价态 | +2 | +3 | +2、+3 |
| 水溶性 | 不溶 | 不溶 | 不溶 |
| 与酸反应 | FeO+2H+==Fe2++H2O | Fe2O3+6H+==2Fe3++3H2O | Fe3O4+8H+==Fe2++2Fe3++4H2O |
| 用途 | 玻璃色料 | 油漆、颜料 | 做颜料和抛光剂 |
| 氧化性 | 高温时都能与C、CO、H2反应,被还原生成Fe单质 | ||
乙酸分子的组成与结构:
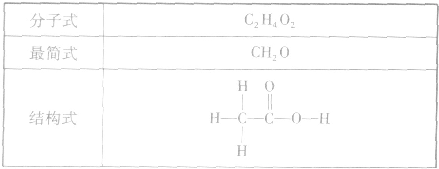
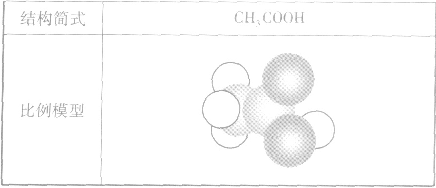
酸从结构上可以看成是甲基和羧基(-COOH)相连而成的化合物。乙酸的官能团是一COOH。
乙酸的性质:
俗称醋酸,具有强烈刺激性气味的无色液体。沸点117.9℃,熔点16.6℃。温度低于熔点时,乙酸凝结成类似冰一样的晶体,纯净的乙酸称为冰醋酸。乙酸溶于水和乙醇。
(1)乙酸的酸性:乙酸的酸性促使它还可以与碳酸钠、氢氧化铜、苯酚钠等物质反应。
2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O
2CH3COOH+Cu(OH)2=Cu(CH3COO)2+2H2O
CH3COOH+C6H5ONa=C6H5OH(苯酚)+CH3COONa
(2)乙酸与金属反应:
2Na+2CH3COOH→2CH3COONa+H2↑
(3)乙酸的酯化反应:
在浓硫酸作用下乙酸和乙醇反应酯化反应
CH3COOH+CH3CH2OH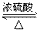 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
与“进行下列反应后,所得溶液中一定只含一种溶质的是[ ]A.Fe3O4...”考查相似的试题有:
- 将由Mg和Al组成的一定质量的混合物投入500 mL 稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,...
- (16分)镁砂(MgO)是一种高温耐火材料。下图是氨法制取高纯镁砂的部分工艺流程: 请回答:(1)MgCl2•6H2O溶于水,溶液呈 (...
- (4分)铝、铁两种金属的单质及其化合物在生产、生活中有着广泛的应用。请回答:(1)两种金属与稀盐酸反应,除都生成氢气外...
- 向含1mol HCl和1mol MgSO4的混合溶液中加入1mol·L—1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系...
- 某化学课外活动小组在实验室做了如下一系列实验:该小组设计了如图1所示的一套气体发生、收集和尾气吸收装置以探究装置的多功...
- 铁是人类较早使用的金属之一,根据所学铁及其化合物的知识,回答下列问题:(1)下列各物质中,不能和单质铝反应的物质是____...
- 下列关于有机物的说法正确的是[ ]A.CH4与Cl2以体积比1︰4混合,光照时可制得纯净的CCl4B.煤的干馏可以得到苯、甲苯等重要的化...
- A.B.C.D分别是乙烷、乙烯、苯、乙酸的一种,(1)四种物质中只有A不属于烃类,也不能和H2反应;(2)B能与溴反应而使溴水...
- 下列物质既能使酸性高锰酸钾溶液褪色,又能使溴水褪色,还能和氢氧化钠反应的是( )A.乙酸B.乙酸甲酯C.油酸甘油酯D.苯甲酸
- 可以说明醋酸是弱酸的事实是( )A.CH3COOH能与水以任意比互溶B.CH3COOH能与Na2CO3溶液反应产生CO2气体C.1mol/L的CH3COOH...