本试题 “分别取40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.(1)理论上稀强酸、...” 主要考查您对中和热的测定
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 中和热的测定
中和热测定:
(1)目的:①用量热法测定HCl与NaOH的中和热。②了解化学标定法,并掌握其操作。
(2)原理:在298K、溶液足够稀的情况下,1molOH-与1molH+中和,可放出57.3.kJ的热量。即:H+(aq)+OH-(aq) =H2O(aq) △H=-57.3kJ/mol
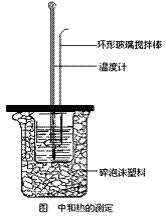
(3)仪器和实验:大烧杯(500 mL)、小烧杯(100 mL)、温度计、量筒(50mL)两个、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。0.50 mol/L 盐酸、0.55 mol/L NaOH溶液。
(4)步骤:
①在大烧杯底垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的,如图所示。该实验也可在保温杯中进行。
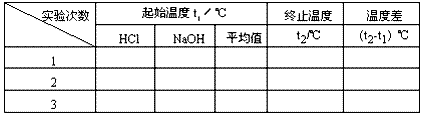
②用一个量筒量取50mL0.50mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。然后把温度计上的酸用水冲洗干净。
③用另一个量筒量取50mL 0.55 mol/L NaOH溶液,并用温度计测量NaOH溶液的温度,记入下表。
④把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面)。用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入下表。
⑤重复实验两次,取测量所得数据的平均值作为计算依据。
⑥根据实验数据计算中和热。
(1)目的:①用量热法测定HCl与NaOH的中和热。②了解化学标定法,并掌握其操作。
(2)原理:在298K、溶液足够稀的情况下,1molOH-与1molH+中和,可放出57.3.kJ的热量。即:H+(aq)+OH-(aq) =H2O(aq) △H=-57.3kJ/mol
(3)仪器和实验:大烧杯(500 mL)、小烧杯(100 mL)、温度计、量筒(50mL)两个、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。0.50 mol/L 盐酸、0.55 mol/L NaOH溶液。
(4)步骤:
①在大烧杯底垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的,如图所示。该实验也可在保温杯中进行。

②用一个量筒量取50mL0.50mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。然后把温度计上的酸用水冲洗干净。
③用另一个量筒量取50mL 0.55 mol/L NaOH溶液,并用温度计测量NaOH溶液的温度,记入下表。
④把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面)。用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入下表。
⑤重复实验两次,取测量所得数据的平均值作为计算依据。

⑥根据实验数据计算中和热。
发现相似题
与“分别取40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液进...”考查相似的试题有:
- (1)欲量取20.00mL Na2CO3溶液,应选用的仪器是_________________。(2)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计...
- 下列说法不正确的是[ ]A.能够发生化学反应的碰撞是有效碰撞B.升高温度会加快化学反应速率,其原因是增加了活化分子的百分数...
- 在测定中和热的实验中,下列说法正确的是( ) A.使用环形玻璃棒是为了加快反应速率,减小实验误差 B.为了准确测定反应混合...
- 在测定中和热的实验中,下列说法中正确的是[ ]A.该实验需要用的主要玻璃仪器有:两个大小相同的烧杯、两只大小相同的量筒、...
- 下列说法正确的是( )A.中和热一定是强酸跟强碱反应放出的热量B.凡经加热而发生的化学反应都是吸热反应C.测定中和热的实...
- 某实验小组设计用50 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液进行中和反应,测定中和热,试回答下列中和热测定中的有关问题...
- 下列有关定量实验的叙述中,正确的是( ) A..配制500 mL 1 mol•L-1稀硫酸实验中,稀释后立即进行后续各项操作,所配溶液浓...
- 下列说法正确的是( )A.量筒和酸碱式滴定管均没有“0”刻度B.用湿润的pH试纸测NaOH溶液,测得的pH值比实际的大C.在中和热的...
- 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热...
- 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示 的装置中进行中和反应。通过测定反应过程中所放出的热量可 计算中...