本试题 “甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为: CO(g)+2H2(g) CH3OH (g) △H1(反应Ⅰ)该反应的原料CO和H2本身都...” 主要考查您对焓变、反应热
中和热
燃烧热
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 焓变、反应热
- 中和热
- 燃烧热
反应热,焓变:
化学能可以转化为热能、电能和光能等,化学反应中的能量变化,通常主要表现为热量的变化。
1.定义:在化学反应过程中,当生成物和反应物具有相同温度时所放出或吸收的热量,通常叫做化学反应的反应热。在恒温、恒压条件下,化学反应过程中吸收或放出的热量称为反应的焓变。
2.符号:△Ⅳ
3.单位:kJ·mol-1
4.产生原因:化学反应过程中旧键断裂吸收的总能量与新键形成释放的总能量不相等,故化学反应均伴随着能量变化——吸热或放热。
5.表示方法:放热反应的△H<0,吸热反应的△H>0.
化学能可以转化为热能、电能和光能等,化学反应中的能量变化,通常主要表现为热量的变化。
1.定义:在化学反应过程中,当生成物和反应物具有相同温度时所放出或吸收的热量,通常叫做化学反应的反应热。在恒温、恒压条件下,化学反应过程中吸收或放出的热量称为反应的焓变。
2.符号:△Ⅳ
3.单位:kJ·mol-1
4.产生原因:化学反应过程中旧键断裂吸收的总能量与新键形成释放的总能量不相等,故化学反应均伴随着能量变化——吸热或放热。
5.表示方法:放热反应的△H<0,吸热反应的△H>0.
中和热:
在稀溶液中,酸和碱发生中和反应生成1molH2O时的反应热。中和热的表示方法: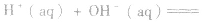
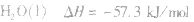
在稀溶液中,酸和碱发生中和反应生成1molH2O时的反应热。中和热的表示方法:
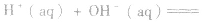
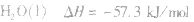
影响中和热测定的因素:
中和反应巾放出的热量为(m1+m1)·c·(t1-t2),其巾溶液的比热容c是已知的,对于给定的反应物的质量m1和m2也是定值,这样求算出的中和热是否接近 57.3kl·mol-1,取决于溶液温度的变化。
在整个实验过程中应把好两关:①隔热关。如:小烧杯周围的泡沫塑料要填满;盖板上两孔只要正好使温度计和环形玻璃搅拌棒通过即可;倒人NaOH溶液要迅速等,尽可能减少实验过程中热量的散失。②准确关。如:配制溶液的浓度要准;NaOH溶液要新制,因为久置的NaOH溶液可能变质导致浓度不准;量取液体体积时读数要准;对溶液温度要读到最高点。
注意事项:
(1)这里的溶液一般要求是稀溶液,这是因为浓酸溶液和浓碱溶液相互稀释时会放出热量
(2)强酸与强碱的反应实质是H+和OH-反应(即与酸、碱的种类无关),通过多次实验测定,1molH+和1molOH-反应生成lmol H2O(l)时,放出的热量为 57.3kJ
(3)中和热是以生成1molH2O为基准的,因此表示中和热的热化学方程式中,水的化学计量数为1,酸、碱的化学计量数可以为分数
燃烧热:
在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。单位为kJ/mol
注意事项:
(1)规定是在101kPa 下测出的热量。书中提供的燃烧热数据都是在25℃、101kPa下测定出来的
(2)规定可燃物的物质的量为1mol(这样才有可比性)。因此,表示可燃物的燃烧热的热化学方程式中,可燃物的化学计量数为1,其他物质的化学计量数常出现分数
(3)规定生成稳定的氧化物,例如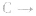
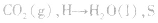
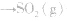 等
等
(4)叙述燃烧热时、不用“+”“-”,在热化学方程式中用△H表示时取“-”
在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。单位为kJ/mol
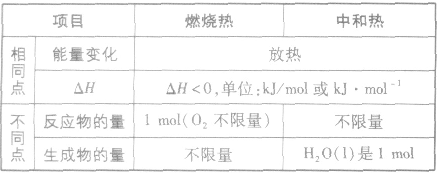
燃烧热和中和热的异同:
注意事项:
(1)规定是在101kPa 下测出的热量。书中提供的燃烧热数据都是在25℃、101kPa下测定出来的
(2)规定可燃物的物质的量为1mol(这样才有可比性)。因此,表示可燃物的燃烧热的热化学方程式中,可燃物的化学计量数为1,其他物质的化学计量数常出现分数
(3)规定生成稳定的氧化物,例如
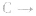
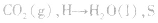
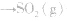 等
等 (4)叙述燃烧热时、不用“+”“-”,在热化学方程式中用△H表示时取“-”
发现相似题
与“甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备...”考查相似的试题有:
- 甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为: CO(g)+2H2(g) CH3OH (g) △H1(...
- 已知下列反应的平衡常数:(1)HCNH++ CN-, K(1)Θ=" 4.9" ×10-10(2)NH3+ H2ONH4++ OH-, K(2)Θ=" 1.8" ×10-5 (3...
- 下列关于热化学反应的描述中正确的是( )A.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),...
- 最近几年我国已加大对氮氧化物排放的控制力度。消除氮氧化物污染有多种方法。(l)用CH4还原氮氧化物可以消除氮氧化物的污染...
- 已知1mol硫化氢完全燃烧生成水蒸气时放出热量为500KJ,且氧气中1molO=O键完全断裂时吸收热量600KJ,水蒸气中1molH-O键形成时...
- 氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车备受青睐。我国拥有完全自主知识产权的氢燃料电池...
- (6分)发射卫星用N2H4为燃料,NO2为氧化剂,两者反应生成N2和水蒸气, 已知N2(g)+2O2(g)=2NO2(g) ⊿ H1 = + 67.7kJ/mol;N2H4(...
- 下列说法或表述正确的是( )A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多B.由单质A转化为单质B是一个吸热过程...
- 18 g炭粉燃烧所得气体中CO占,CO2占;且C(s)+O2(g)===CO(g) ΔH=-110.35 kJ·mol-1,CO(g)+O2(g)===CO2(g) ΔH=-282.57 ...
- Ⅰ.将由Na+、Ba2+、Cu2+、SO42-、Cl-组合形成的三种强电解质溶液,分别装入下图装置中的甲、乙、丙三个烧杯中进行电解,...