本试题 “已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A试回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)(1)基态Ga原子的核...” 主要考查您对电子排布式
杂化轨道理论(中心原子杂化方式)
配合物理论
电离能
σ键、π键
范德华力
氢键
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电子排布式
- 杂化轨道理论(中心原子杂化方式)
- 配合物理论
- 电离能
- σ键、π键
- 范德华力
- 氢键
电子排布式:
①简化电子排布式
为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相应稀有气体的冗素符号外加方括号表示,即为简化电子排布式,如K 的简化电子排布式为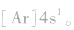
②特殊电子排布式
有个别元素的基态原子的电子排布对于构造原理有1个电子的反常。因为能量相同的原子轨道在全充满( )、半充满(
)、半充满(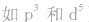 )和全空(
)和全空(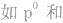
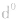 )状态时,体系的能量较低,原子较稳定。
)状态时,体系的能量较低,原子较稳定。 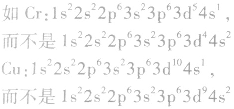
(2)电子排布图:用方框表示一个原子轨道,用箭头“↑”或“↓”来区别自旋状态不同的电子。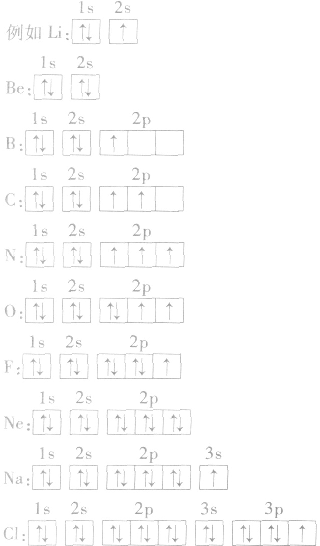
构造原理:
多电子原子的核外电子排布总是按照能量最低原理,由低能级逐步填充到高能级。绝大多数元素的原子核外电子的排布遵循下图所示的排布顺序,这种排布顺序被称为构造原理。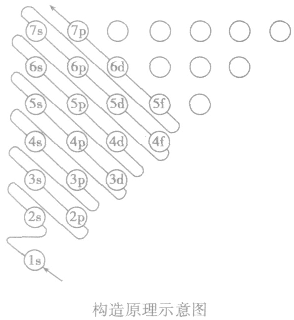
点拨:构造原理中的排布顺序,其实质是各能级的能量高低顺序,可由下列公式得出ns<(n一2)f< (n一1)d<np(n表示能层序数)。常用的重要的能级交错顺序有: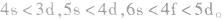
核外电子排布式一构造原理的应用:
根据构造原理,按照能级顺序,用能级符号右上角的数字表示该能级上电子数的式子,叫做电子排布式。例如,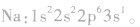
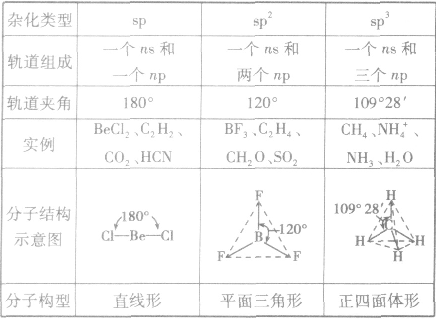
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
分子的构型与杂化类型的关系:
配位键、配合物:
1.配位键配位键是一种特殊的共价键。成键的两个原子间的共用电子对是由一个原子单独提供的。形成配位键的条件是其中一个原子有孤电子对,另一个原子有接受孤电子对的“空轨道”。配位键用A→B表示,A是提供孤电子对的原子,B是接受孤电子对的原子。
2.配合物通常把金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物称为配合物。
3.配位键的形成
(1) 中配位键的形成
中配位键的形成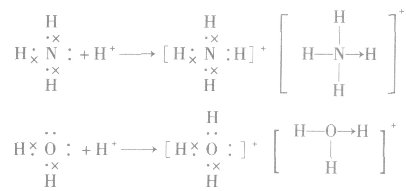
注意:结构式中“→”表示配位键及其共用电子对的提供方式。
(2)配离子 中配位键的形成
中配位键的形成
在 里,NH3分子中的氮原子给出孤电子对,
里,NH3分子中的氮原子给出孤电子对, 接受电子对,以配位键形成了
接受电子对,以配位键形成了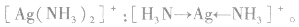
(3)配离子 的形成
的形成
在 里,
里, 分子中的氮原子给出孤电子对,
分子中的氮原子给出孤电子对, 接受电子对,以配位键形成了
接受电子对,以配位键形成了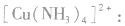
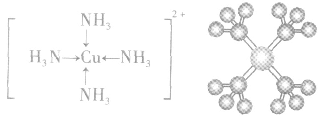
4.配合物的组成
配合物的组成包含中心原子、配体和配位原子、配位数,内界和外界等。以 为例说明,如下图所示:
为例说明,如下图所示: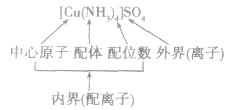
配合物的内界和外界之间多以离子键结合,因而属于离子化合物、强电解质,能完全电离成内界离子和外界离子,内界离子也能电离但程度非常小,可谓“强中有弱”。例如,配合物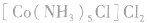 溶液中加入
溶液中加入 溶液,外界的
溶液,外界的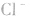 能被沉淀,而内界的
能被沉淀,而内界的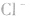 不能形成沉淀。
不能形成沉淀。
电离能:
(1)概念
气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。
(2)元素第一电离能的意义:可以衡量元素的原子在气态时失去一个电子的难易程度。第一电离能数值越小,在气态时原子越容易失去一个电子;第一电离能数值越大,在气态时原子越难失去一个电子。
(3)电离能的变化规律
①随核电荷数递增,元素的第一电离能呈周期性变化。
②同一周期内,随着原子序数的增加,原子半径逐渐变小(稀有气体除外),原子核对外层电子的吸引越来越强,元素的原子越来越难失电子,因此元素的第一电离能呈增大的趋势。同一周期内,碱金属元素的第一电离能最小,稀有气体元素的第一电离能最大。
③同一主族,从上到下,随着原子序数的增加,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的吸引越来越弱,元素的原子越来越易失电子,故同一主族,随着电子层数的增加,元素的第一电离能逐渐减小。注意通常ⅡA族元素的第一电离能大于ⅢA 族元素、VA族元素的第一电离能大于ⅥA族元素。这是由于ⅡA、VA族元素原子的价电子排布分别为 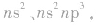 是较稳定的全充满或半充满状态,因而失去电子所需的能量较高。
是较稳定的全充满或半充满状态,因而失去电子所需的能量较高。
成键原子的电子云以“头碰头”方式重叠形成的共价键,其特征是轴对称,即以形成化学键的两原子核的连线为轴作旋转,共价键的电子云图形不变。
π键:
成键原子的电子云以“肩并肩”方式形成的共价键,其特征是镜像对称,即:电子云由两块组成,若以包含原子核的平面为镜面,两块电子云互为镜像。
共价键的分类:
(1)按成键原子是否相同或共用电子对是否偏移分 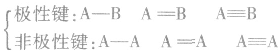
(2)按成键方式分

(3)按共用电子对数分
范德华力:
(1)概念:分子之间普遍存在的一种把分子聚集在一起的相互作用力。范德华力的作用能通常比化学键的键能小得多,一般只有2~20kJ/mol,主要影响物质的物理性质(熔、沸点和溶解度等)。
(2)规律:组成和结构相似的由分子构成的物质,相对分子质量越大,范德华力越大,物质的熔、沸点越高。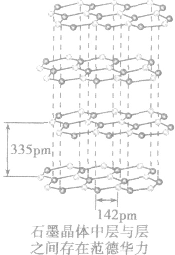
水分子间氢键的表示方法及意义:
(1)表示方法:如下图所示

(2)意义:水分子问存在氢键,使水的熔点和沸点升高,高于同主族其他元素的气态氢化物,所以常温常压下水呈液态。另外,在同态水(冰晶体)中,水分子间以氢键结合成排列规整的晶体,水分子间的氢键使冰的结构里存在较大的空隙,造成体积膨胀、密度减小至低于液态水的密度。水的这种性质对水生动物的生存有重要意义。
范德华力和氢键:
| 范德华力 | 氢键 | |
| 概念 | 把分子聚集在一起的作用力 | 分子中与氢原子形成共价键的非金属元素原子如果吸引电子的能力很强,原子半径很小,则使氢原子几乎成为“裸露”的质子,带部分正电荷,这样的分子之间氢核与带部分负电荷的非金属元素原子相互吸引,这种静电作用就是氢键 |
| 存在范围 | 分子之间 | 某些含强极性键的氢化物分子间(如 HF、H2O、NH3)等 |
| 强弱比较 | 比化学键弱得多 | 比化学键弱,但比范德华力强 |
| 影响因素 | 组成和结构相似的由分子组成的物质,相对分子质量越大,范德华力越大 | 形成氢键的除H外的非金属元素原子吸引电子的能力越强,半径越小,则氢键越强 |
| 对物质性质的影响 | 影响物质的熔沸点、溶解度等物理性质。一般来说,组成和结构相似的由分子组成的物质,随相对分子质量的增大,物质的熔沸点升高,如熔沸点: 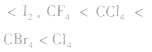 |
分子间氢键的存在,使物质的熔沸点升高,在水中的溶解度增大,如熔沸点:H2O 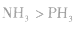 |
氢键:
(1)概念:已经与电负性很大的原子(如N、O、F) 形成共价键的氢原子与另一个电负性很大的原子(如 N、O、F)之问的作用力。如水分子问的氢键如下图所示。 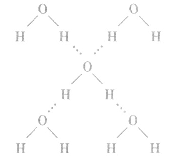
(2)表示方法:A—H…B一(A、B为N、O、F“一” 表示共价键,“…”表示形成的氢键)。
(3)分类
(4)属性:氢键不属于化学键,它属于一一种较强的分子间作用力,其作用能大小介于范德华力和化学键之间。
(5)对物质性质的影响
①氢键对物质熔、沸点的影响。分子问存在氧键时,破坏分子问的氢键,需要消耗更多的能量,所以存在氢键的物质具有较高的熔点和沸点。
例如:氮族、氧族、卤素中的N、O、F的氧化物的熔、沸点的反常现象。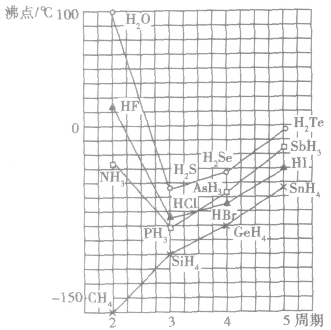
②氢键对物质溶解度的影响:氢键的存在使物质的溶解性增大。例如:NH3极易溶解于水,主要是由于氨分子和水分子之问形成了氢键,彼此互相缔合,因而加大了溶解。再如乙醇、低级醛易溶于水,也是因为它们能与水分子形成氢键。
③氢键的存在会引起密度的变化。水结冰时体积膨胀、密度减小的反常现象也可用氢键解释:在水蒸气中水以单个的水分子形式存在;在液态水中,通常是几个水分子通过氢键结合,形成(H2O)n小集团;在固态水(冰)中,水分子大范围地以氢键互相连接,成为疏松的晶体,因此在冰的结构中有许多空隙,造成体积膨胀,密度减小。
④分子内氢键与分子间氢键对物质性质的不同影响:氢键既可以存在于分子内部的原子之间,也可以存在于分子间的原子之间,只不过这两种情况对物质性质的影响程度是不一样的。例如,邻羟基苯甲醛存在分子内氢键: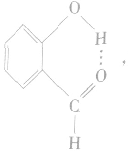 熔点为2℃,沸点为196. 5℃;对羟基苯甲醛存在分子间氢键:
熔点为2℃,沸点为196. 5℃;对羟基苯甲醛存在分子间氢键: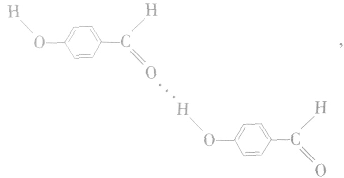 熔点为 115℃,沸点为250℃。由此可见,分子间氢键使物质的熔、沸点更高。
熔点为 115℃,沸点为250℃。由此可见,分子间氢键使物质的熔、沸点更高。
6)存在:水、醇、羧酸、酰胺、氨基酸、蛋白质、结晶水合物等物质中都能存在;生命体中许多大分子内也存在氢键,如氢键是蛋白质具有生物活性的高级结构的重要原因,DNA双螺旋的两个螺旋链也是以氢键相互结合的。
与“已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核...”考查相似的试题有:
- 下列微粒中,与NH4+具有相同的质子数和相同电子数的是( )A.FB.NH3C.CH4D.Na+
- 和氖原子电子层结构相同的微粒是( )A.Na+B.Cl-C.K+D.Ar
- 某元素R原子的核外电子数等于核内中子数,该元素的单质2.8g,与氧气充分反应,可得到6g化合物RO2,则该元素的原子( )A.具...
- 下列分子中的中心原子杂化轨道的类型相同的是( )A.SO3与SO2B.BF3与NH3C.BeCl2与SCl2D.C2H2与C2H4
- 决定物质性质的重要因素是物质结构。请回答下列问题。(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示A的化...
- 有关苯分子中的化学键描述正确的是[ ]A.每个碳原子的sp2杂化轨道中的其中一个形成大π键B.每个碳原子的未参加杂化的2p轨道形...
- 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。...
- 【二选一—物质结构与性质】碳、氧、铁、铜等是与人类生产、生活息息相关的化学元素。(1)基态铜原子的价电子排布式为_______...
- 下列物质的分子中既有σ键,又有π键的是[ ]①HCl②H2O③N2④H2O2⑤C2H4⑥C2H2A.①②③B.③④⑤⑥C.①③⑥D.③⑤⑥
- 有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子...