本试题 “下列有关物质性质、结构的表述均正确,且存在因果关系的是[ ]表述I 表述ⅡA. 在水中,NaCl的溶解度比I2的溶解度大NaCl晶体中Cl-与Na+间的作用力大于碘晶体中分...” 主要考查您对溶解性
共价化合物
键能、键长、键角
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 溶解性
- 共价化合物
- 键能、键长、键角
溶解性:
(1)相似相溶原理:极性分子易溶于极性分子溶剂中(如HCl易溶于水中),非极性分子易溶于非极性分子溶剂中(如CO2易溶于CS2中)
(2)分子结构:含有相同官能团且该官能团在分子中所占比重较大的物质能够相互溶解。如:乙醇与水互溶;戊醇不能与水互溶、与己烷能互溶。
(3)分子之间能形成氢键,会增大溶解度。
(4)溶质若能与溶剂发生反应,溶解度会增大。
(1)相似相溶原理:极性分子易溶于极性分子溶剂中(如HCl易溶于水中),非极性分子易溶于非极性分子溶剂中(如CO2易溶于CS2中)
(2)分子结构:含有相同官能团且该官能团在分子中所占比重较大的物质能够相互溶解。如:乙醇与水互溶;戊醇不能与水互溶、与己烷能互溶。
(3)分子之间能形成氢键,会增大溶解度。
(4)溶质若能与溶剂发生反应,溶解度会增大。
影响物质溶解性的因素:
1.看溶质与水能否发生反应
溶质若能与水发生反应,则会增大溶质的溶解度,如
2.分子的极性
非极性分子构成的物质易溶于非极性溶剂,难溶于极性溶剂;极性分子构成的物质易溶于极性溶剂,难溶于非极性溶剂。如苯易溶于植物油而难溶于水; NH3、HCl易溶于水而难溶于苯。
3.氢键
溶质与溶剂分子之间若能形成分子问氢键,会增大溶质的溶解度。如NH3、HF都能与H2O形成分子间氢键,溶解度较大。
定义:
直接相邻原子间均以共价键相结合的化合物。共价化合物中只含共价键。
离子化合物和共价化合物的比较:

直接相邻原子间均以共价键相结合的化合物。共价化合物中只含共价键。
离子化合物和共价化合物的比较:

共价键的键参数:
(1)键能:指气态基态原子形成1mol化学键释放的最低能量。键能越大,化学键越稳定。
(2)键长:指成键原子的核间距。键长越短,共价键越稳定。
注意:我们通常通过比较两原子的共价半径来比较共价单键键长的大小,但共价键的键长并不等于两原子的共价半径之和。
(3)键角:在多原子分子内,两个共价键之间的夹角。
键角是描述分子立体结构的重要参数。多原子分子的键角是一定的,表明共价键具有方向性。

说明:键长、键能决定共价键的强弱和分子的稳定性。原子半径越小,键长越短,键能越大,分子越稳定。例如, 分子中:
分子中:
X原子半径: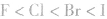
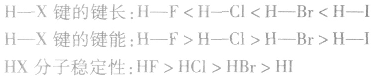
(1)键能:指气态基态原子形成1mol化学键释放的最低能量。键能越大,化学键越稳定。
(2)键长:指成键原子的核间距。键长越短,共价键越稳定。
注意:我们通常通过比较两原子的共价半径来比较共价单键键长的大小,但共价键的键长并不等于两原子的共价半径之和。
(3)键角:在多原子分子内,两个共价键之间的夹角。
键角是描述分子立体结构的重要参数。多原子分子的键角是一定的,表明共价键具有方向性。

说明:键长、键能决定共价键的强弱和分子的稳定性。原子半径越小,键长越短,键能越大,分子越稳定。例如,
 分子中:
分子中: X原子半径:
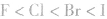
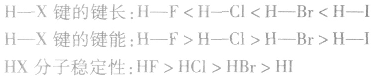
发现相似题
与“下列有关物质性质、结构的表述均正确,且存在因果关系的是[ ]...”考查相似的试题有:
- 同族元素的同类物质的结构、性质既有相似性,也有特殊性。回答下列问题:(1)已知酸性FCH2COOH>CH3COOH,试推断:①BrCH2COOH、...
- PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:(1...
- 下列叙述正确的是[ ]A.含有离子键的化合物一定是离子化合物B.含有共价键的化合物一定是共价化合物C.离子化合物中不可能含...
- 下列说法正确的是[ ]A.IA族元素的金属性一定比IIA族元素的金属性强B.ⅥA族元素中氢化物最稳定的其沸点一定最高C.非金属元素...
- 在下列物质中:①CO2②KCl ③CaBr2④O2⑤NH4Cl ⑥Ca(OH)2⑦N2⑧HBr ⑨NH3⑩Na2O2,试用以上编号填空:(1)只有非极性键的是_______;(...
- 下列说法中,不正确的是[ ]A、双原子分子中的共价键,一定是非极性键B、非极性键也可能存在于离子化合物中C、分子间作用力,...
- Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子结构相同...
- 部分中学化学常见元素原子结构及性质如表所示:(1)A原子基态时的电子排布式为___。(2)B与C形成的化合物的化学式为____,它属...
- 下列关于离子化合物、共价化合物的叙述正确的是[ ]A.离子化合物可能含有共价键B.共价化合物可能含离子键C.离子化合物中一...
- ①有机物都是从有机体中分离出来的物质,②有机物都是含碳的共价化合物,③有机物都不溶于水,易溶于有机溶剂,④有机物不具备无...