本试题 “(I)滴定分析法是化学分析法中的重要分析方法之一.(一)用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).A.实验步骤:(1)用酸式滴定管量取10.00mL食...” 主要考查您对酸碱中和滴定
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 酸碱中和滴定
酸碱中和滴定:
用已知物质的量浓度的酸(或碱)来测 定未知物质的量浓度的碱(或酸)的方法叫做酸碱中和滴定。
(1)原理:对于一元酸和一元碱发生的中和反应,C酸V酸=C碱V碱 或:C未知V未知=C标准V标准,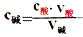
(2)仪器:a.酸式滴定管 b.碱式滴定管c.铁架台d.滴定管夹e.锥形瓶 f.烧杯g.胶头滴管等
(3)装置图: 
(4)操作步骤:
洗涤、检漏、水洗、润洗、装液、去泡、调液面记录、放待测液、加指示剂、滴定、记录、
计算、误差分析
(5)数据处理依据:
c(NaOH)=c(HCl)V(HCl)/V(NaOH)
(6)误差分析:
①仪器润洗不当:
a.盛标准液的滴定管用蒸馏水洗后未用标准液润洗;
b.盛待测液滴定(移液)管用蒸馏水洗后未用待测液润洗;
c.锥形瓶用蒸馏水洗后再用待测液润洗;
②读数方法有误:
a.滴定前仰视,滴定后俯视;
b.滴定前俯视,滴定后仰视;
c.天平或量筒的使用读数方法错误;
③操作出现问题:
a.盛标准液的滴定管漏液;
b.盛待测液的滴定管滴前尖嘴部分有气泡,终了无气泡
(或前无后有);
c.振荡锥形瓶时,不小心有待测液溅出;
d.滴定过程中,将标准液滴到锥形瓶外;
中和滴定中的误差分析:
中和滴定是一个要求较高的定量实验,每一个不当的或错误的操作都会引起误差。
对于一元酸与一元碱,由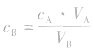 可知,
可知,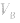 是准 确量取的体积,
是准 确量取的体积, 是标准溶液的浓度,它们均为定值,所以
是标准溶液的浓度,它们均为定值,所以 的大小取决于
的大小取决于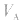 的大小,
的大小,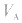 大则
大则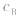 大,
大,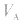 小则
小则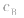 小。
小。
以标准酸溶液滴定末知浓度的碱溶液(酚酞作指示剂)为例,常见的不正确操作对实验结果的影响见下表: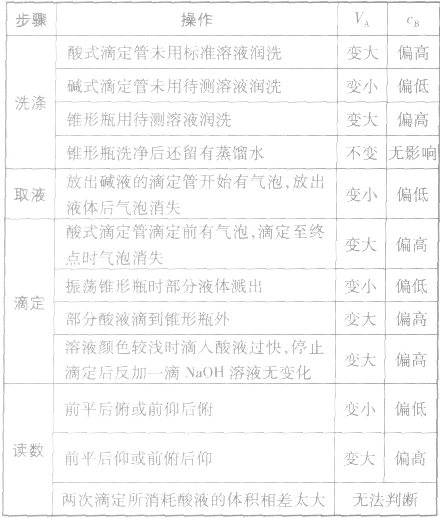
中和滴定应注意的问题:
1.中和滴定中指示剂的使用与选择
(1)用量不能太多,常用2~3滴,冈指示剂本身也是有机弱酸或有机弱碱,若用量太多,会使中和滴定中需要的酸或碱的量增多或减少。
(2)指示剂的选择:中和滴定时一般选用的指示剂有酚酞和甲基橙。石蕊试液由于颜色变化不明显,不易辨别,在滴定过程中不宜使用。
(3)酸、碱恰好完全反应时,终点溶液的pH应在指示剂的变色范围内,如强酸溶液滴定弱碱溶液应选用甲基橙作指示剂;强碱溶液滴定弱酸溶液应选用酚酞作指示剂。
(4)指示剂的变色:最好由浅到深,这样对比明显。如用强碱滴定强酸用酚酞作指示剂较好,当酚酞从无色变为粉红色(或浅红色)且半分钟内不褪色时即达到滴定终点。
2.欲减小实验误差的三点做法
(1)半分钟:振荡,半分钟内颜色不褪去,即为滴定终点。
(2)l一2min:滴定停止后,必须等待l~2min,让附着在滴定管内壁的溶液流下后,再进行读数。
(3)重复:同一实验,要做两到三次,两次滴定所用标准溶液的体积的差值不能超过0.02mL,再取平均值。
与“(I)滴定分析法是化学分析法中的重要分析方法之一.(一)用...”考查相似的试题有:
- 某校学生用中和滴定法测定某NaOH溶液的物质的量浓度.(1)盛装0.2000mol/L盐酸标准液应该用______式滴定管.(2)当接近滴定...
- 用标准盐酸滴定未知浓度的氨水时,对指示剂的最佳选择是[ ]A.酚酞B.甲基橙C.石蕊D.前三者均可
- 纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用.制备纳米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,经过滤、水洗...
- 某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:(A)移取20.00mL待测的盐酸溶液注入洁净的锥形...
- 下列实验操作正确的是( )A.测定某浓度盐酸的pH时,先将pH试纸用蒸馏水湿润B.蒸馏时,将温度计的水银球插入蒸馏烧瓶中液面...
- 某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液...
- 当用碱滴定酸时,下列操作中可能使测定结果(酸的浓度)偏低的是( )A.滴定后读取标准液体积时仰视B.锥形瓶用蒸馏水洗后,...
- 下列实验方案和操作中合理的是( )A.SO42-的检验:加入HNO3酸化的BaCl2溶液,观察是否有白色沉淀生成B.除去NO中混有的少量...
- 实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定NaOH的质量分数约为82.0%,为了验证其纯度,用浓度为0.2mol/L的盐酸进行滴...
- 酸、碱指示剂本身就是弱酸或弱碱,滴定操作时,酸(碱)首先和被滴定的碱(酸)反应,而后过量酸(碱)和指示剂作用变色,显...