本试题 “将0.1mol/LHF溶液不断加水稀释,下列分析与结论对应正确的是[ ]分析结论A.弱酸稀释时,电离平衡正向移动,溶液中n(H+)增大,pH也增大错误B.温度不变,电离程...” 主要考查您对电离平衡常数
弱电解质电离的影响因素
水电离的影响因素
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电离平衡常数
- 弱电解质电离的影响因素
- 水电离的影响因素
电离平衡常数:
1.概念在一定条件下,弱电解质的电离达到平衡时,溶液中电离所生成的各种离子浓度的乘积与溶液中未电离的分子浓度的比是一个常数,这个常数叫做电离平衡常数,简称电离常数。用K表示(酸用 表示,碱用
表示,碱用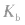 表示)。
表示)。
2.表示方法: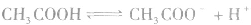
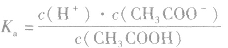
对于多元弱酸,其电离是分步进行的,每步各有电离常数,通常用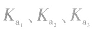 ,等分别表示,且
,等分别表示,且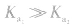
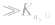
例如: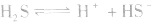
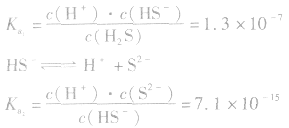
3.影响因素:温度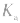 (或
(或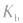 )只随温度变化而变化,不随浓度变化而变化。电离平衡常数,类似于化学平衡常数.
)只随温度变化而变化,不随浓度变化而变化。电离平衡常数,类似于化学平衡常数.
4.意义:反映弱酸,弱碱酸碱性的相对强弱在一定温度下, 越大(多元弱酸以
越大(多元弱酸以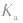 为依据),弱酸的电离程度就越大,浓度相同时c(H+)也越大,弱酸的酸性越强。
为依据),弱酸的电离程度就越大,浓度相同时c(H+)也越大,弱酸的酸性越强。
1.概念在一定条件下,弱电解质的电离达到平衡时,溶液中电离所生成的各种离子浓度的乘积与溶液中未电离的分子浓度的比是一个常数,这个常数叫做电离平衡常数,简称电离常数。用K表示(酸用
 表示,碱用
表示,碱用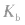 表示)。
表示)。 2.表示方法:
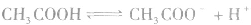
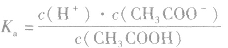
对于多元弱酸,其电离是分步进行的,每步各有电离常数,通常用
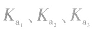 ,等分别表示,且
,等分别表示,且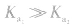
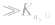
例如:
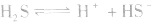
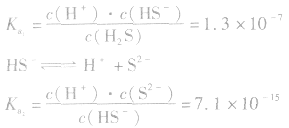
3.影响因素:温度
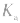 (或
(或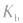 )只随温度变化而变化,不随浓度变化而变化。电离平衡常数,类似于化学平衡常数.
)只随温度变化而变化,不随浓度变化而变化。电离平衡常数,类似于化学平衡常数.4.意义:反映弱酸,弱碱酸碱性的相对强弱在一定温度下,
 越大(多元弱酸以
越大(多元弱酸以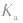 为依据),弱酸的电离程度就越大,浓度相同时c(H+)也越大,弱酸的酸性越强。
为依据),弱酸的电离程度就越大,浓度相同时c(H+)也越大,弱酸的酸性越强。电离平衡的影响因素:
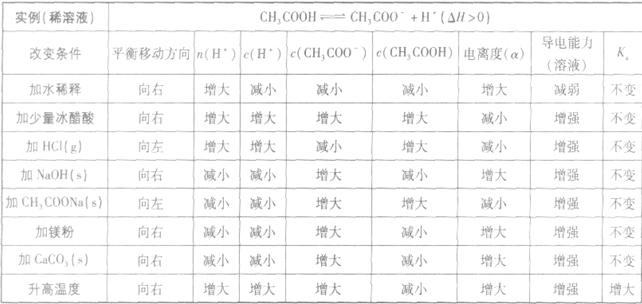
(1)温度:由于弱电解质的电离是吸热过程,故升高温度,将使弱电解质的电离平衡向电离方向移动。
(2)浓度:对于同一弱电解质来说,浓度越小,离子相互碰撞结合成分子的机会越小,弱电解质的电离程度就越大。因此,加水稀释溶液会使弱电解质的电离平衡向电离的方向移动,电离程度增大,电离出的离子的总量增加,但离子浓度是减小的。
(3)同离子效应:加入与弱电解质具有相同的离子的强电解质则抑制弱电解质的电离。
(4)化学反应:在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质,可促进弱电解质的电离。
以醋酸归纳为例:
(1)温度:由于弱电解质的电离是吸热过程,故升高温度,将使弱电解质的电离平衡向电离方向移动。
(2)浓度:对于同一弱电解质来说,浓度越小,离子相互碰撞结合成分子的机会越小,弱电解质的电离程度就越大。因此,加水稀释溶液会使弱电解质的电离平衡向电离的方向移动,电离程度增大,电离出的离子的总量增加,但离子浓度是减小的。
(3)同离子效应:加入与弱电解质具有相同的离子的强电解质则抑制弱电解质的电离。
(4)化学反应:在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质,可促进弱电解质的电离。
以醋酸归纳为例:

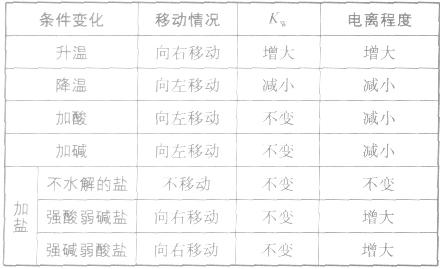
影响水电离平衡的因素:
发现相似题
与“将0.1mol/LHF溶液不断加水稀释,下列分析与结论对应正确的是[...”考查相似的试题有:
- 已知下面三个数据:7.2×10-4、4.6×10-4、4.9 ×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:NaCN+HN...
- 回答下列问题。(1)常温时,FeCl3溶液的pH 7(填“>”、“<”或“=”),实验室配制FeCl3溶液时常将FeCl3固体先溶于较浓的盐酸...
- 下列叙述正确的是[ ]A.25℃时,将稀氨水逐滴加入到稀硫酸中,当pH=7时,2c(NH4+)=c(SO42-)B.将pH=4的醋酸溶液稀释后,...
- 在0.1mol·L-1HC1O溶液中存在如下电离平衡:HC1OC1O-+ H+,对于该平衡,在温度不变时,下列叙述正确的是[ ]A.加入水时,平衡...
- 下列有关说法正确的是A.0.1 mol/L NH4C1溶液加蒸馏水稀释,溶液的pH不断减小B.常温下,pH=2的CH3COOH溶液与pH=12的NaOH...
- 健康人血液中的pH保持在一定范围内变化,这是因为血液中存在如下平衡:H2CO3+H+,医学上称为血液酸碱平衡,试解答下列问题:(...
- 下图是用0.1000 mol·mol—1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答: ...
- 对于常温下0.0lmol/L的氨水,下列叙述正确的是A.c(H+)+c(NH4+)=c(OH-)B.与等体积等浓度的氯化铵溶液混合c(NH4+)+c(NH3· H2...
- (6分)从、、、、五种物质中:(1)选取溶于水中会促进水电离,且溶液显碱性的物质,用离子方程式表示溶液其显碱性的原因: ;(2...
- 室温下,水的电离达到平衡:H2OH++OH-。下列叙述正确的是( )A.将水加热,平衡正向移动,KW变小B.向水中加入少量NaOH固...