本试题 “钴(Co)化物对化学键的研究有重要的作用。为测定某钴化物[Co(NH3)xCly]Clz的组成,进行了如下实验(1)称取样品0.5010 g ,加入过量NaOH溶液,煮沸,蒸出所有...” 主要考查您对氧化还原反应的计算
金属、非金属的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化还原反应的计算
- 金属、非金属的有关计算
(1)比较典型的计算有:求氧化剂、还原剂物质的量之比或质量比,计算参加反应的氧化剂货还原剂的量,确定反应前后某一元素的价态变化等。
(2)计算的依据是:氧化剂得电子数等于还原剂失电子数,列出守恒关系式求解。
氧化还原反应的基本规律:
1.守恒规律
氧化还原反应中有物质失电子必有物质得电子,且失电子总数等于得电子总数。或者说氧化还原反应中,有元素化合价升高必有元素化合价降低,且化合价升高总数必等于降低总数。有关得失电子守恒(化合价守恒)的规律有如下应用:
(1)求某一反应中被氧化与被还原的元素原子个数之比,或求氧化剂与还原剂的物质的量之比及氧化产物与还原产物的物质的量之比。
(2)配平氧化还原反应方程式。
(3)进行有关氧化还原反应的计算:
2.强弱规律
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。应用:在适宜条件下,用氧化性较强的物质制备氧化性较弱的物质,或用还原性较强的物质制备还原性较弱的物质,也可用于比较物质间氧化性或还原性的强弱。
3.价态规律
元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要表现一种性质。物质若含有多种元素,其性质是这些元素性质的综合体现。
4.转化规律
氧化还原反应中,以元素相邻价态之间的转化最容易;不同价态的同种元素之间发生反应,元素的化合价只靠近,不交叉;相邻价态的同种元素之间不发生氧化还原反应。如

5.难易规律
越易失去电子的物质,失去后就越难得到电子;越易得到电子的物质,得到后就越难失去电子。一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应;同理,一种还原剂同时与多种氧化剂相遇时,氧化性最强的优先发生反应,如向FeBr2溶液中通入Cl2时,发生离子反应的先后顺序为:
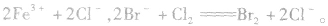 。
。
包括金属及化合物、金属与非金属化合物、非金属化合物之间的反应的计算,解此类题的关键是正确的写出反应方程式,明确物质间的等量关系。明确物质之间的反应,正确写出方程式,此类题可迎刃而解。
AlCl3与NaOH反应的相关计算:
1、求Al(OH)3沉淀的量
2、求反应物碱的量
铝与酸、碱反应的计算规律:
铝分别与盐酸、氢氧化钠溶液反应的原理: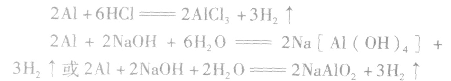
(1)等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气的体积比为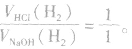
(2)足量的锅分别与等物质的量的盐酸和氢氧化钠溶液反应,产生氢气的体积比为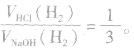
(3)一定量的铝分别和一定量的盐酸和氢氧化钠溶液反应,若产生氢气的体积比为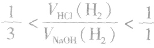 ,则必定是:
,则必定是:
①铝与盐酸反应时,铝过量而盐酸不足;
②铝与氢氧化钠溶液反应时,铝不足而氢氧化钠过量。
解有关硝酸与金属反应的计算题的技巧:
1.灵活运用得失电子守恒、原子守恒及溶液中的电荷守恒关系例如Cu与HNO3反应中就有以下等量关系:
(1)N原子守恒:反应前所有的N只存在于HNO3中;反应后含N的物质有HNO3的还原产物(假设此处有NO3、NO)和Cu(NO3)3,若HNO3过量,则过量HNO3中也含一部分N,则有:n(N)=n(NO2)+ n(NO)+2n[Cu(NO3)3]+n剩(HNO3)。
(2)得失电子守恒:在反应中失去电子的是参加反应的Cu, ;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),NO3-+e→ NO2、NO3-+3e→NO。根据得失电子守恒,则有:
;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),NO3-+e→ NO2、NO3-+3e→NO。根据得失电子守恒,则有: 
(3)溶液中的电荷守恒:在任何溶液中,阴离子所带负电荷总数与阳离子所带正电荷总数在数值上是相等的。在Cu与HNO3反应后的溶液中,若HNO3不过量,阳离子只有Cu2+,阴离子只有NO3-(此类计算不考虑H2O电离出的极少量的H+、OH-);若HNO3过量,溶液中阳离子有Cu2+和H+,阴离子只有NO3-。则有:
①若HNO3不过量: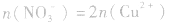
②若HNO3过量: 
2.铁与稀HNO3的反应规律 

(2)上述反应可以认为先发生反应①,若Fe有剩余则发生 ①×2+ ③即得反应②,所以,无论是反应①还是反应②,被还原的HNO3皆占参加反应的HNO3的
①×2+ ③即得反应②,所以,无论是反应①还是反应②,被还原的HNO3皆占参加反应的HNO3的 。
。
有关镁、铝的图像集锦:
Al(OH)3与Al3+、AlO2-之间的转化,是建立在 Al(OH)3两性基础上的,有关相互转化的配比和沉淀Al(OH)3的质量变化,见下表:
与“钴(Co)化物对化学键的研究有重要的作用。为测定某钴化物[Co(N...”考查相似的试题有:
- 硫代硫酸钠溶液与盐酸的反应(Na2S2O3+2HCl===2NaCl+S+SO2+H2O ),可用于探究浓度对于反应速率的影响。常温常压下,若该反应...
- 已知反应:①Cl2+2KBr==2KCl+Br2,②KClO3+6HCl(浓)==3Cl2↑+KCl +3H2O,③2KBrO3+Cl2==Br2+2KClO3,下列说法正确的是[ ]A.上...
- 实验室用17.4g MnO2与足量的浓度为12mol/L的浓盐酸反应制取氯气。(1)产生的Cl2在标准状况下的体积为多少?(2)理论上被氧...
- 在100 mE稀盐酸中加入混合均匀的NaHCO3和KHCO3固体粉末,充分反应后使气体全部逸出。下图是加入粉末的质量与产生CO2体积(标...
- 将盛有N2和NO2混合气体的试管倒立于水中,经过足够的时间后,试管内的气体体积缩小为原体积的一半,则原混合气体中N2与NO2的...
- 钛白粉(主要成分是TiO2),广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂。下图是以钛铁矿(主要成分FeT...
- 刘明用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有...
- 0.025mol某硫酸盐晶体MSO4·x H2O的质量为7.175g,其中结晶水占43.9%,则x值为[ ]A.2B.3C.5D.7
- 某原子AZX,它的氯化物XCl 5.85g溶于水制成溶液后,加入2mol/L的AgNO3溶液50mol恰好完全反应。若这种原子原子核内有12个中子...
- 在标准状况下,由排空气法收集一瓶氯化氢气体,测得烧瓶内气体对氢气的相对密度为17,现将烧瓶倒立于水中,则进入烧瓶中水的...