本试题 “已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可...” 主要考查您对氧化剂、还原剂
离子反应
溶液的酸碱性
电解池电极反应式的书写
电冶金
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化剂、还原剂
- 离子反应
- 溶液的酸碱性
- 电解池电极反应式的书写
- 电冶金
氧化剂:
(1)定义:得到电子(或电子对偏向)的物质,在反应时所含元素的化合价降低。
(2)常见的氧化剂:
①活泼非金属单质:如 Cl2、Br2、O2等。
②某些高价氧化物,如SO3、MnO2等。
③氧化性含氧酸,如 浓H2SO4、HNO3、HClO等
④元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、K2Cr2O7、KClO3、FeCl3等。
⑤过氧化物,如Na2O2、H2O2等。
⑥某些金属阳离子:如Ag+、Fe3+等
还原剂:
(1)定义:失去电子(或电子对偏离)的物质,在反应时所含元素的化合价升高。
(2)常见的还原剂:
①活泼金属单质:如 Na、A1、Zn、Fe等。
②低价态的金属阳离子:如Fe2+等;
③某些非金属单质:如 H2、C等。
④元素(如C、S等)处于低价时的氧化物,如CO、NO、SO2等。
⑤元素(如Cl、S等)处于低化合价时的氢化物:如 H2S、HCl、HI、NH3等 。
⑥元素(如S、Fe等)处于低化合价时的盐或酸,如Na2SO3、H2SO3、H2C2O4、FeSO4等。
(1)定义:得到电子(或电子对偏向)的物质,在反应时所含元素的化合价降低。
(2)常见的氧化剂:
①活泼非金属单质:如 Cl2、Br2、O2等。
②某些高价氧化物,如SO3、MnO2等。
③氧化性含氧酸,如 浓H2SO4、HNO3、HClO等
④元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、K2Cr2O7、KClO3、FeCl3等。
⑤过氧化物,如Na2O2、H2O2等。
⑥某些金属阳离子:如Ag+、Fe3+等
还原剂:
(1)定义:失去电子(或电子对偏离)的物质,在反应时所含元素的化合价升高。
(2)常见的还原剂:
①活泼金属单质:如 Na、A1、Zn、Fe等。
②低价态的金属阳离子:如Fe2+等;
③某些非金属单质:如 H2、C等。
④元素(如C、S等)处于低价时的氧化物,如CO、NO、SO2等。
⑤元素(如Cl、S等)处于低化合价时的氢化物:如 H2S、HCl、HI、NH3等 。
⑥元素(如S、Fe等)处于低化合价时的盐或酸,如Na2SO3、H2SO3、H2C2O4、FeSO4等。
常见的氧化剂及对应的还原产物:
|
氧化剂 |
还原产物 |
| Cl2、ClO- | Cl- |
| KMnO4(H+)、MnO2 | Mn2+ |
| HNO3 | NOx、N2、NH4+ |
| 浓H2SO4 | SO2 |
| Ag+、Fe3+ | Ag、Fe2+ |
| H2O2 | H2O |
常见的还原剂及对应的氧化产物:
|
还原剂 |
氧化产物 |
|
Na、K等金属单质 |
Na+、K+ |
|
某些非金属C、S |
CO2、SO2 |
|
非金属的氢化物CH4、H2S、NH3等 |
CO2、S/SO2、NO |
|
某些低价态的氧化物CO、SO2 |
CO2、SO3 |
|
某些低价态的酸或盐H2SO3、Na2SO3等 |
SO42- |
|
某些低价态的阳离子Fe2+ |
Fe3+ |
|
H2O2 |
O2 |
易错易混点:
(1)金属单质只具有还原性,金属最高价阳离子只具有氧化性,处于中间价态的物质既有氧化性,又有还原性;
(2)非金属单质常作氧化剂,某些非金属单质也是较强的还原性物质,比如H2、C等等
(3)元素化合价的变化:
①元素最低价只有还原性,最高价只有氧化性,中间价态既有氧化性又有还原性
②同一元素在反应中化合价发生变化,只能接近不能交叉。
例如: 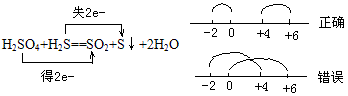
定义:
凡是有离子参加或离子生成的反应都是离子反应。
离子反应包括:复分解反应、氧化还原反应、络合反应、双水解反应
常见阳离子的检验方法:
常见阴离子的检验方法:
注意: 1.若SO42-与Cl-同时检验,需注意检验顺序。应先用Ba(NO3)2溶液将SO42-检出,并滤去BaSO4,然后再用AgNO3检验Cl-。
2.检验SO32-的试剂中,只能用盐酸,不能用稀硝酸。因为稀硝酸能把SO32-氧化成SO42-。
3.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出并滤去沉淀,然后再用稀硫酸检验Ba2+。
凡是有离子参加或离子生成的反应都是离子反应。
离子反应包括:复分解反应、氧化还原反应、络合反应、双水解反应
常见阳离子的检验方法:
| 离子 | 检验试剂 | 实验步骤 | 实验现象 | 离子方程式 |
| K+ | 焰色反应 | ①铂丝在火焰上灼烧至原火焰色②蘸取溶液,放在火焰上灼烧,观察火焰颜色。 | 浅紫色(通过蓝色钴玻璃片观察钾离子焰色) | —— |
| Na+ | 焰色反应 | 火焰分别呈黄色 | ||
| NH4+ | NaOH溶液(浓) | 向未知溶液中加入NaOH浓溶液并加热 | 生成有刺激性气味、使湿润红色石蕊试纸变蓝的气体 | NH4++OH-=NH3↑+H2O |
| Al3+ | 加NaOH溶液 | 向未知溶液中加入NaOH溶液 | 加入适量NaOH溶液后生成白色沉淀,该沉淀溶于过量NaOH溶液中 |
Al3++3OH-=Al(OH)3↓ |
| Cu2+ | 浓氨水 | 向未知溶液中加入浓氨水 | 加入适量浓氨水后生成蓝色沉淀,该沉淀溶于过量浓氨水中,溶液呈深蓝色 |
Cu2++2OH-=Cu(OH)2↓ Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O |
| Ag+ | ①稀盐酸或可溶性盐酸盐②稀HNO3③氨水 | 向未知溶液中加入稀盐酸再加入稀HNO3向过滤出的沉淀中加氨水 | 生成白色沉淀,不溶于稀HNO3,但溶于氨水,生成[Ag(NH3)2]+ | Ag++Cl-=AgCl↓ |
| Ba2+ | 稀H2SO4或可溶性酸盐溶液 | 向未知溶液中加入稀H2SO4再加入稀HNO3 | 产生白色沉淀,且沉淀不溶于稀HNO3 | Ba2++SO42-=BaSO4↓ |
| Fe3+ | KSCN溶液 | 向未知溶液中加入KSCN溶液或加NaOH溶液或加苯酚 | 变为血红色溶液 | Fe3++3SCN-=Fe(SCN)3 |
| 加NaOH溶液 | 产生红褐色沉淀 | Fe3++3OH-=Fe(OH)3↓ | ||
| 加苯酚 | 溶液显紫色 | Fe3++6C6H6OH→[Fe(C6H5O)]3-+6H+ | ||
| Fe2+ | ①加NaOH溶液 | 向未知溶液中加入NaOH溶液并露置在空气中 | 开始时生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。 | Fe2++2OH-=Fe(OH)2↓ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| ②KMnO4 (H+)溶液 | 向未知溶液中加入KMnO4(H+)溶液 | KMnO4(H+)紫色褪去 | MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O | |
| ③K3[Fe(CN)6] | 向未知溶液中加入K3[Fe(CN)6]溶液 | 出现蓝色Fe3[Fe(CN)6]2沉淀 | 3Fe2++2[Fe(CN)6]-=Fe3[Fe(CN)6]2↓ | |
| ④KSCN溶液,新制的氯水 | 加入KSCN溶液,新制的氯水 | 加入KSCN溶液不显红色,加入少量新制的氯水后,立即显红色。 | 2Fe2++Cl2=2Fe3++2Cl-Fe3++3SCN-=Fe(SCN)3 |
常见阴离子的检验方法:
| 离子 | 检验试剂 | 实验步骤 | 实验现象 | 离子方程式 |
| CO32- | ①BaCl2溶液、稀盐酸 | 向未知溶液中加入BaCl2溶液再向沉淀中加入稀盐酸 | 加入BaCl2溶液后生成白色沉淀,沉淀溶于稀盐酸,并放出无色无味气体 | Ba2++CO32-=BaCO3↓ BaCO3+2H+=Ba2++CO2↑+H2O |
| ②稀盐酸、Ca(OH)2溶液 | 加入稀盐酸后放出的气体通入使澄清的Ca(OH)2溶液 | 加入稀盐酸后放出无色无味气体,通入澄清的Ca(OH)2溶液变浑浊 | CO32-+2H+=H2O+CO2↑ Ca2++2OH-+CO2=CaCO3↓+H2O | |
| SO42- | BaCl2溶液、稀硝酸或稀盐酸 | 向未知溶液中加入BaCl2溶液再向沉淀中加入稀盐酸 | 生成不溶于稀硝酸或稀盐酸的白色沉淀 | Ba2++SO42-=BaSO4↓ |
| SO32- | ①BaCl2溶液、稀盐酸 | 向未知溶液中加入BaCl2溶液再向沉淀中加入稀盐酸 | 加入BaCl2溶液后生成白色沉淀,沉淀溶于稀盐酸,并放出刺激性气味的气体 | SO32-+2H+=H2O+SO2↑ |
| ②稀盐酸、品红溶液 | 加入稀盐酸后放出的气体通入品红溶液 | 加入稀盐酸后放出的气体使品红溶液褪色 | SO32-+2H+=H2O+SO2↑ | |
| Cl- | AgNO3溶液、稀硝酸或稀盐酸 | 向未知溶液中加入AgNO3溶液,再向沉淀中加入稀盐酸 | 生成不溶于稀硝酸或稀盐酸的白色沉淀 | Ag++Cl-=AgCl↓ |
| Br- | AgNO3溶液、稀硝酸或稀盐酸 | 生成不溶于稀硝酸或稀盐酸的浅黄色沉淀 | Ag++Br-=AgBr↓ | |
| I- | AgNO3溶液、稀硝酸或稀盐酸 | 向未知溶液中加入AgNO3溶液,再向沉淀中加入稀盐酸 | 生成不溶于稀硝酸的黄色沉淀 | Ag++I-=AgI↓ |
| ②新制氯水,淀粉溶液 | 向未知溶液中加入新制氯水,再加入淀粉溶液 | 滴入新制Cl2,振荡后再滴入淀粉溶液,变蓝 | Ag++I-=AgI↓ 2I-+Cl2=I2+2Cl- I2遇淀粉变蓝 |
2.检验SO32-的试剂中,只能用盐酸,不能用稀硝酸。因为稀硝酸能把SO32-氧化成SO42-。
3.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出并滤去沉淀,然后再用稀硫酸检验Ba2+。
溶液的酸碱性:
(1)pH=-lg[c(H+)],在溶液的c(H+)很小时,用pH来表示溶液的酸度。
(2)pH越大,c(H+)越小,c(OH-)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
(3)pH的范围:0~14
(4)溶液酸碱性判断:
当c(H+)>c(OH-)时,溶液呈酸性;
当c(H+)>=c(OH-)时,溶液呈键性;
当c(H+)<c(OH-)时,溶液呈中性。
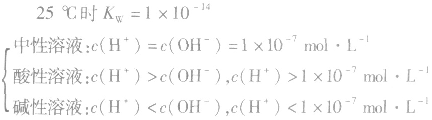
(5)关于pH相同的酸(含强酸和弱酸)
①溶液中c(H+)相等(填“相等”或“不等”)。
②溶液中溶质的物质的量的浓度:强酸<弱酸(填“>”或“<”)。
③耗碱规律:pH和溶液体积均相同的HCl、H2SO4、CH3COOH与碱完全反应时,消耗碱物质的量最多的是CH3COOH。
④稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m,强酸中c(H+)变为原来的1/m,但弱酸中c(H+)减小小于(填“大于”或“小于”)m倍,故稀释后弱酸酸性强于强酸。
(1)pH=-lg[c(H+)],在溶液的c(H+)很小时,用pH来表示溶液的酸度。
(2)pH越大,c(H+)越小,c(OH-)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
(3)pH的范围:0~14
(4)溶液酸碱性判断:
当c(H+)>c(OH-)时,溶液呈酸性;
当c(H+)>=c(OH-)时,溶液呈键性;
当c(H+)<c(OH-)时,溶液呈中性。
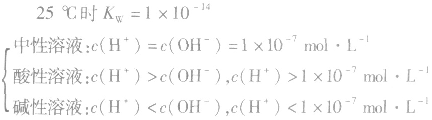
(5)关于pH相同的酸(含强酸和弱酸)
①溶液中c(H+)相等(填“相等”或“不等”)。
②溶液中溶质的物质的量的浓度:强酸<弱酸(填“>”或“<”)。
③耗碱规律:pH和溶液体积均相同的HCl、H2SO4、CH3COOH与碱完全反应时,消耗碱物质的量最多的是CH3COOH。
④稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m,强酸中c(H+)变为原来的1/m,但弱酸中c(H+)减小小于(填“大于”或“小于”)m倍,故稀释后弱酸酸性强于强酸。
溶液的pH:
1.定义:溶液里H+的物质的量浓度的负对数叫做pH。
2.表达式:
3.含义: pH越大,c(H+)越小,c(O-一)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
4.适用范围:
c(H+)很小时,用pH来表示溶液的酸碱度更方便。所以,pH适用于酸、碱的稀溶液
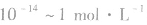 之间],pH取值范刚为0~14。
之间],pH取值范刚为0~14。
5.溶液的酸碱性和pH: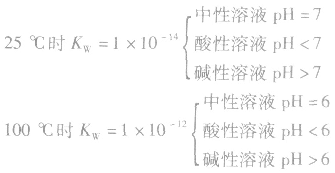
电极反应式的书写:
1.根据装置书写电极反应式
(1)根据电源确定阴、阳两极→确定阳极是否是活性电极→据电极类型及电解质溶液中阴、阳离子的放电顺序写出电极反应式。
(2)在确保阴、阳两极转移电子数目相同的条件下,将两极电极反应式合并即得总反应式。
2.由氧化还原反应方程式书写电极反应式
(1)找出发生氧化反应和还原反应的物质→确定两极名称和生成物→利用电子守恒分别写出两极反应式。
(2)若写出一极反应式,而另一极反应式不好写,可用总反应式减去已写出的电极反应式,即得另一电极反应式。
1.根据装置书写电极反应式
(1)根据电源确定阴、阳两极→确定阳极是否是活性电极→据电极类型及电解质溶液中阴、阳离子的放电顺序写出电极反应式。
(2)在确保阴、阳两极转移电子数目相同的条件下,将两极电极反应式合并即得总反应式。
2.由氧化还原反应方程式书写电极反应式
(1)找出发生氧化反应和还原反应的物质→确定两极名称和生成物→利用电子守恒分别写出两极反应式。
(2)若写出一极反应式,而另一极反应式不好写,可用总反应式减去已写出的电极反应式,即得另一电极反应式。
电冶金:
(1)电解法:用电解的手段将活泼金属(如Na、Ca、 Mg、Al)从它们的化合物中还原出来的方法。
(2)实例
a.电解熔融NaCl制Na
b.电解熔融Al2O3制Al
发现相似题
与“已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物...”考查相似的试题有:
- 全球海水中溴的藏量丰富,约占地球溴总藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg/L。其工业提取方法有:(1)空...
- 实验室可用KMnO4固体和浓盐酸反应制氯气,反应的化学方程式如下:2KMnO4+16HCl(浓)2KCl+2MnCl2+5Cl2↑+8H2O。(1)该反应中氧...
- (6分)已知A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:① A + B→白...
- 对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。(1)现有下列五种物质:SO2、SiO2、CaO、MgO...
- (10分)某化学兴趣小组在课外活动中,对某溶液进行了三次检验,每次检验结果如下表所示,请回答下列问题。检验次数溶液中检...
- (18分)现有Cu2+、Cl―、Na+、SO42―、Zn2+两两组成的电解质溶液若干种,可选用铜电极、铂电极、锌电极进行电解实验。(1)...
- 下列化学用语的表示中,正确的是( ) A.电镀时,要在铁上镀银,则正极为银,电极反应式为:Ag++e-=Ag B.电解饱和食盐水时...
- 写出(1)钠原子结构示意图_______________(2)氯化氢的电子式_______________(3)氧族元素第四周期元素符号______________...
- 用石墨作电极,电解下列物质的溶液,其实质不是电解水的是( )A.NaNO3B.NaOHC.Na2SO4D.NaCl
- (改编)下列说法正确的是( )A.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率B.电解MgCl2饱和溶液,可制得金属镁C.用苯萃...