本试题 “下列各选项中所述的两个量,前者一定大于后者的是[ ]A. pH=10的NaOH和Na2CO3溶液中,水的电离程度B. 物质的量浓度相等的(NH4)2SO4溶液与(NH4)2CO3溶液中NH4+...” 主要考查您对强酸和弱酸的比较
水的电离平衡
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 强酸和弱酸的比较
- 水的电离平衡
强酸与弱酸(或强碱与弱碱)的比较:
1.强酸与弱酸(或强碱与弱碱)由于电离程度的不同,在很多方面表现出不同的性质 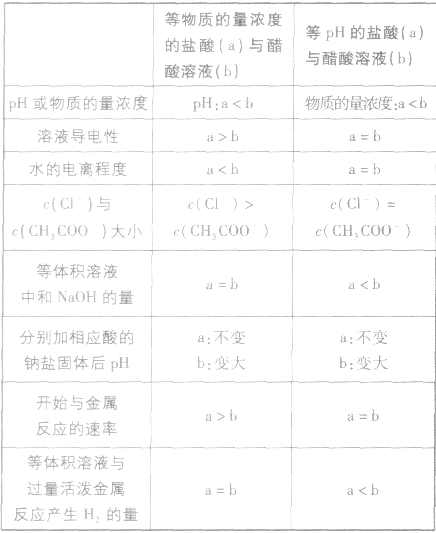
2.稀释时pH变化特点比较如下图:a、b分别为体积相等、pH相等的NaOH溶液和氨水的稀释曲线线;c、d分别为体积相等、pH相等的盐酸和醋酸溶液的稀释曲线,请体会图中的两层含义: 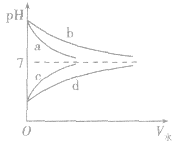
(1)加水稀释相同倍数后的pH大小:氨水>NaOH溶液,盐酸>醋酸溶液。若稀释10n倍,盐酸、Na0H溶液pH变化n个单位,而氨水与醋酸溶液pH变化小到 n个单位。
(2)稀释后的pH仍然相等,则加水量的大小:氨水 >NaOH溶液,醋酸溶液>盐酸。
水的电离:
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O
 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L 注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
发现相似题
与“下列各选项中所述的两个量,前者一定大于后者的是[ ]A. pH=10...”考查相似的试题有:
- 下列表述中正确的是[ ]A. 任何能使熵值增大的过程都能自发进行B. △H<0,△S>0的化学反应一定能自发进行C. 已知热化学方程式2...
- 常温时,向pH = 2的硫酸溶液中加入等体积的下列溶液后,滴入甲基橙试液,出现红色,该溶液可能是( )A.pH = 12的Ba(OH)2B....
- 试回答下列问题(温度均为25℃时):(1)将0.2mol/L HB溶液与0.1mol /L MOH溶液等体积混合,测得混合溶液的pH=4,则混合溶液...
- 碳酸(H2CO3)是二元弱酸,碳酸氢钾溶液呈碱性。在0.1mol/LKHCO3溶液中,下列关系正确的是( )A.c(K+)+c(H+)=c(HCO3-)+c(OH...
- 某探究小组在某温度下测定溶液的pH值时发现,0.01mol·L-1的NaOH溶液中,由水电离出的c(H+)·c(OH-)=10-22(mol·L-1)2,则该...
- A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为红棕色。有关的转化关系如下图所示(反应条件均已略去)。请...
- I、今有①CH3COOH、②HCl、③H2SO4三种溶液,选择序号填空:A.①>②>③ B.①<②<③ C.①=②=③ D.①=③>②E.①>②=③ F.①<②=③...
- 某温度下, pH值相同的盐酸和氯化铵溶液分别稀释,平衡pH值随溶液体积变化的曲线如下图所示。据图判断下列叙述中,正确的是(...
- 对于常温下pH= 3的乙酸溶液,下列说法正确的是A.c(H+)=c(CH3COO-)+c(OH-)B.加水稀释到原体积的10倍后溶液pH变为4C.加入...
- (7分) t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:(1)该温度下,水的离子积常数kw= 。(2...