本试题 “(1)氨分子中氮原子采用sp3杂化,可为什么氨分子为三角锥形,键角是107°?________________________________(2)为什么H2O分子的键角既不是90° 也不是109°2...” 主要考查您对杂化轨道理论(中心原子杂化方式)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 杂化轨道理论(中心原子杂化方式)
杂化轨道理论:
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
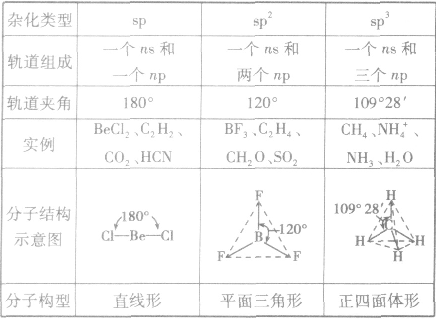
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
分子的构型与杂化类型的关系:
发现相似题
与“(1)氨分子中氮原子采用sp3杂化,可为什么氨分子为三角锥形...”考查相似的试题有:
- 下列对sp3、sp2、sp杂化轨道的夹角的比较,得出结论正确的是[ ]A.sp杂化轨道的夹角最大B.sp2杂化轨道的夹角最大C.sp3杂化...
- 利用有关知识回答下列问题:(1)B、F两元素形成化合物的空间构型为____,其中心原子的杂化类型为___。(2)CH4与____(写微粒符...
- 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。 ...
- I.下列分子中,属于非极性分子的是______A、SO2B、BeCl2C、BBr3D、COCl2II.铜(Cu)是重要金属,Cu的化合物在科学研究和工...
- 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢...
- 有A、B、C、D、E五种短周期元素,其中A元素和B元素的原子都有一个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道...
- [三选一选修3:物质结构与性质]下表为周期表的一部分,其中的编号代表所对应的元素。请回答下列问题:(1)⑨号元素的基态原子的...
- [化学--物质结构与性质]四种常见元素:A、B、C、D为周期表前四周期元素,原子序数依次递增,它们的性质或结构信息如下表.试...
- 氟元素因其半径小和电负性高,可以与金属和非金属生成最高氧化态的化合物,例如MnF2、SF6、IF7等。OF2可由单质氟与稀氢氧化钠...
- 决定物质性质的重要因素是物质结构。请回答下列问题。(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示A的化...