本试题 “现有常温下的四份溶液:①0. 10 mol/L CH3COOH;②0.050 mol/L H2SO4;③pH=13的氨水;④pH=13的Ba(OH)2。下列说法正确的是[ ]A.将②滴入③中,若呈中性,则消耗的...” 主要考查您对弱电解质的电离
强电解质电离(氯化钠、硫酸氢钠等物质的电离)
水电离的影响因素
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 弱电解质的电离
- 强电解质电离(氯化钠、硫酸氢钠等物质的电离)
- 水电离的影响因素
定义:
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:
(2)动: 的动态平衡
的动态平衡
(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:

(2)动:
 的动态平衡
的动态平衡(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
强电解质电离:
强电解质在溶液中完全电离,且符号为“=”,如NaCl=Na++Cl-、NaHSO4==Na++H++SO42-
强电解质在溶液中完全电离,且符号为“=”,如NaCl=Na++Cl-、NaHSO4==Na++H++SO42-
酸与碱反应的几种情况:
1.等体积、等物质的量浓度的酸 混合
混合 
2.等体积的酸 混合
混合 
3.若酸 等体积混合溶液呈中性
等体积混合溶液呈中性 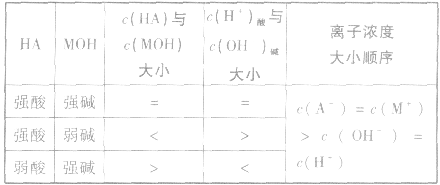
4.强酸溶液(pH=a)与强碱溶液(pH=b)完全中和时的体积比

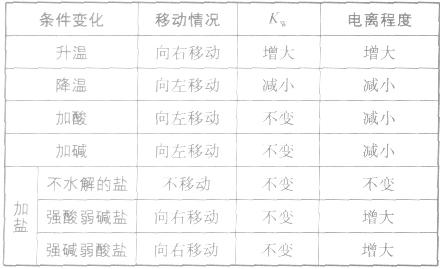
影响水电离平衡的因素:
发现相似题
与“现有常温下的四份溶液:①0. 10 mol/L CH3COOH;②0.050 mol/L ...”考查相似的试题有:
- 室温下向一定量的稀氨水中加入水稀释后,下列说法正确的是( )A.因为稀释,溶液中所有离子的浓度均减小B.溶液中[c(H+)·c(N...
- 下列说法正确的是[ ]A. pH=2与pH=1的硝酸中c(H+)之比为1: 10B. Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1C. 0.2 mol/L与0.1 mo...
- 常温下,用0.1000 mol·L-1NaOH溶液滴定20.00mL0.1000 mol·L-1CH3COOH溶液所得滴定曲线如图。下列说法正确的是[ ]A.点①所...
- 某合作学习小组的同学对冰醋酸在25℃下的稀释过程,有如下思辨,你认为不正确的是( )A.醋酸的电离常数不变B.溶液中c(H+)...
- 某盐的溶液中含有Na+、Mg2+、Cl-、SO42-四种离子,若Na+为0.2mol,Mg2+为0.4mol,Cl-为0.4mol,则SO42-物质的量为( )A.0.1...
- 将5.13g Ba(OH)2粉末加入100 ml硫酸和盐酸的混合液中,充分反应至沉淀不再生成时,过滤得干燥沉淀5.825g。取滤液20ml跟足量铁...
- 将0.1mol/LHF溶液不断加水稀释,下列分析与结论对应正确的是[ ]分析结论A.弱酸稀释时,电离平衡正向移动,溶液中n(H+)增大,p...
- 室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说...
- 已知NaHSO4在水中的电离方程式:NaHSO4=Na++H++SO42-。某温度向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变测得溶液pH为2。...
- [双选题]在25℃某稀溶液中,由水电离产生的c(H+)=10-13mol·L-1,下列有关溶液的叙述正确的是( )A.该溶液一定呈酸性B.该...