本试题 “硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O是一种重要化学试剂,实验室用除去锌镀层的铁片来制取硫酸亚铁铵,流程如下请回答下列问题:(1)确定锌镀层被除去的标志是__...” 主要考查您对硫酸亚铁铵的制备
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 硫酸亚铁铵的制备
硫酸亚铁铵的制备:
一、实验目的:
1.学会利用溶解度的差异制备硫酸亚铁铵;掌握硫酸亚铁、硫酸亚铁铵复盐的性质。
2.掌握水浴、减压过滤等基本操作;学习pH试纸、吸管、比色管的使用;学习限量分析。
二、实验原理:
1.铁屑溶于H2SO4,生成FeSO4:Fe+H2SO4=FeSO4+H2↑
2.通常,亚铁盐在空气中易氧化。例如,硫酸亚铁在中性溶液中能被溶于水肿的少量氧气氧化并进而与水作用,甚至析出棕黄色的碱式硫酸铁(或氢氧化铁)沉淀。若往硫酸亚铁溶液中加入与FeSO4相等的物质的量(mol)的硫酸铵,则生成复盐硫酸亚铁铵。硫酸亚铁铵比较稳定,它的六水合物(NH4)2SO4·FeSO4·6H2O不易被空气氧化,在定量分析中常用以配制亚铁离子的标准溶液。像所有的复盐那样,硫酸亚铁铵在水中的溶解度比组成它的每一组份FeSO4或(NH4)2SO4的溶解度都要小。蒸发浓缩所得溶液,可制得浅绿色的硫酸亚铁铵(六水合物)晶体。FeSO4与(NH4)2SO4等物质的量作用,生成溶解度较小的硫酸亚铁铵:FeSO4+(NH4)2SO4+6H2O=(NH4)2SO4·FeSO4·6H2O 硫酸亚铁铵比较稳定,定量分析中常用来配制亚铁离子的标液;和其他复盐一样,硫酸亚铁铵的溶解度比它的每一组分要小。
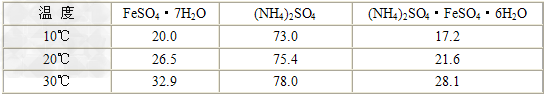
3.比色原理:Fe3++nSCN-=Fe(SCN)n(3-n)(红色)用比色法可估计产品中所含杂质Fe3+的量。Fe3+由于能与SCN-生成红色的物质[Fe(SCN)]2+,当红色较深时,表明产品中含Fe3+较多;当红色较浅时,表明产品中含Fe3+较少。所以,只要将所制备的硫酸亚铁铵晶体与KSCN溶液在比色管中配制成待测溶液,将它所呈现的红色与含一定Fe3+量所配制成的标准Fe(SCN)]2+溶液的红色进行比较,根据红色深浅程度相仿情况,即可知待测溶液中杂质Fe3+的含量,从而可确定产品的等级。三种盐的溶解度(单位为g/100g)数据如下:
用眼睛观察,比较溶液颜色深度以确定物质含量的方法称为目视比色法。常用的目视比色法采用的是标准系列法。用一套由相同质料制成的、形状大小相同的比色管(容量有10、25、50及100mL等),将一系列不同量的标准溶液依次加入各比色管中,再加入等量的显色剂及其他试剂,并控制其他实验条件相同,最后稀释至同样的体积。这样便配成一套颜色逐渐加深的标准色)。将一定量被测试液放在另一比色管中,在同样的条件下显色。从管口垂直向下或从比色管侧面观察,若试液与标准系列中某溶液的颜色深度相同,则这两比色管中的溶液浓度相同;如果试液颜色深度介于相邻两个标准溶液之间,则试液浓度介于这两个标准溶液的浓度之间。
三、仪器与试剂
1.仪器:锥形瓶(150mL,250mL各一个),蒸发皿,玻璃棒,吸滤瓶,布氏漏斗移液管(1mL,2mL各一根),比色管(25mL)烧杯,量筒
2.试剂:铁屑,3mol/L硫酸,(NH4)2SO4(s),3mol/LHCl,250g/LKSCN,Fe3+标准液
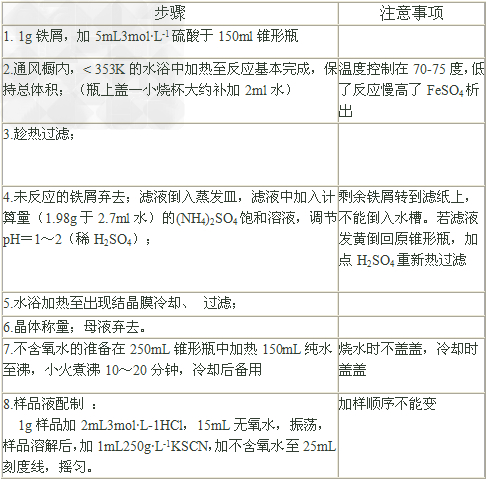
四、实验步骤

五.实验结果及分析
1.制得的(NH4)2SO4·FeSO4·6H2O实际产量:4.05g
理论产量:
Fe—FeSO4—(NH4)2SO4·FeSO4·6H2O
56 392
1.0g 7.0g
产率:4.05/7.0*100%=57.9%
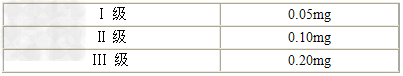
产品等级:<I级
2.分析:所得产品的量比较合适,等级也比较好,主要是温度控制的比较好,而且趁热过滤准备充分,做的比较快,水浴蒸干的火的大小控制的比较好。
一、实验目的:
1.学会利用溶解度的差异制备硫酸亚铁铵;掌握硫酸亚铁、硫酸亚铁铵复盐的性质。
2.掌握水浴、减压过滤等基本操作;学习pH试纸、吸管、比色管的使用;学习限量分析。
二、实验原理:
1.铁屑溶于H2SO4,生成FeSO4:Fe+H2SO4=FeSO4+H2↑
2.通常,亚铁盐在空气中易氧化。例如,硫酸亚铁在中性溶液中能被溶于水肿的少量氧气氧化并进而与水作用,甚至析出棕黄色的碱式硫酸铁(或氢氧化铁)沉淀。若往硫酸亚铁溶液中加入与FeSO4相等的物质的量(mol)的硫酸铵,则生成复盐硫酸亚铁铵。硫酸亚铁铵比较稳定,它的六水合物(NH4)2SO4·FeSO4·6H2O不易被空气氧化,在定量分析中常用以配制亚铁离子的标准溶液。像所有的复盐那样,硫酸亚铁铵在水中的溶解度比组成它的每一组份FeSO4或(NH4)2SO4的溶解度都要小。蒸发浓缩所得溶液,可制得浅绿色的硫酸亚铁铵(六水合物)晶体。FeSO4与(NH4)2SO4等物质的量作用,生成溶解度较小的硫酸亚铁铵:FeSO4+(NH4)2SO4+6H2O=(NH4)2SO4·FeSO4·6H2O 硫酸亚铁铵比较稳定,定量分析中常用来配制亚铁离子的标液;和其他复盐一样,硫酸亚铁铵的溶解度比它的每一组分要小。
3.比色原理:Fe3++nSCN-=Fe(SCN)n(3-n)(红色)用比色法可估计产品中所含杂质Fe3+的量。Fe3+由于能与SCN-生成红色的物质[Fe(SCN)]2+,当红色较深时,表明产品中含Fe3+较多;当红色较浅时,表明产品中含Fe3+较少。所以,只要将所制备的硫酸亚铁铵晶体与KSCN溶液在比色管中配制成待测溶液,将它所呈现的红色与含一定Fe3+量所配制成的标准Fe(SCN)]2+溶液的红色进行比较,根据红色深浅程度相仿情况,即可知待测溶液中杂质Fe3+的含量,从而可确定产品的等级。三种盐的溶解度(单位为g/100g)数据如下:

用眼睛观察,比较溶液颜色深度以确定物质含量的方法称为目视比色法。常用的目视比色法采用的是标准系列法。用一套由相同质料制成的、形状大小相同的比色管(容量有10、25、50及100mL等),将一系列不同量的标准溶液依次加入各比色管中,再加入等量的显色剂及其他试剂,并控制其他实验条件相同,最后稀释至同样的体积。这样便配成一套颜色逐渐加深的标准色)。将一定量被测试液放在另一比色管中,在同样的条件下显色。从管口垂直向下或从比色管侧面观察,若试液与标准系列中某溶液的颜色深度相同,则这两比色管中的溶液浓度相同;如果试液颜色深度介于相邻两个标准溶液之间,则试液浓度介于这两个标准溶液的浓度之间。

三、仪器与试剂
1.仪器:锥形瓶(150mL,250mL各一个),蒸发皿,玻璃棒,吸滤瓶,布氏漏斗移液管(1mL,2mL各一根),比色管(25mL)烧杯,量筒
2.试剂:铁屑,3mol/L硫酸,(NH4)2SO4(s),3mol/LHCl,250g/LKSCN,Fe3+标准液
四、实验步骤


五.实验结果及分析
1.制得的(NH4)2SO4·FeSO4·6H2O实际产量:4.05g
理论产量:
Fe—FeSO4—(NH4)2SO4·FeSO4·6H2O
56 392
1.0g 7.0g
产率:4.05/7.0*100%=57.9%
产品等级:<I级
2.分析:所得产品的量比较合适,等级也比较好,主要是温度控制的比较好,而且趁热过滤准备充分,做的比较快,水浴蒸干的火的大小控制的比较好。
发现相似题
与“硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O是一种重要化学试剂,实验室...”考查相似的试题有:
- 硫酸亚铁容易被氧化,而硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备...
- 硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]又称摩尔盐。某兴趣小组制备硫酸亚铁铵的实验方案示意图如下:已知:H2S、PH3为有毒气体,...
- 下列说法正确的是[ ]A、制备硫酸亚铁铵的实验中最后制得的晶体过滤后用蒸馏水洗涤B、AgI 沉淀中滴入稀KCl溶液,有白色沉淀出...
- 硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O是一种重要化学试剂,实验室用除去锌镀层的铁片来制取硫酸亚铁铵,流程如下请回答下列问题:...
- 某化学实验小组制备硫酸亚铁铵晶体并设计实验测定其组成,他们进行了以下实验:I .向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过...
- 硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O是一种重要化学试剂,实验室用除去锌镀层的铁片来制取硫酸亚铁铵,流程如下请回答下列问题:...