本试题 “下列物质性质的变化规律与分子间作用力有关的是[ ]A.HF、HCl、HBr、HI的热稳定性依次减弱B.金刚石的硬度大于硅,其熔、沸点也高于单晶硅C.NaF、NaCl、NaBr...” 主要考查您对范德华力
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 范德华力
范德华力:
(1)概念:分子之间普遍存在的一种把分子聚集在一起的相互作用力。范德华力的作用能通常比化学键的键能小得多,一般只有2~20kJ/mol,主要影响物质的物理性质(熔、沸点和溶解度等)。
(2)规律:组成和结构相似的由分子构成的物质,相对分子质量越大,范德华力越大,物质的熔、沸点越高。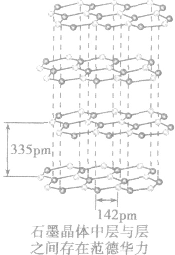
水分子间氢键的表示方法及意义:
(1)表示方法:如下图所示

(2)意义:水分子问存在氢键,使水的熔点和沸点升高,高于同主族其他元素的气态氢化物,所以常温常压下水呈液态。另外,在同态水(冰晶体)中,水分子间以氢键结合成排列规整的晶体,水分子间的氢键使冰的结构里存在较大的空隙,造成体积膨胀、密度减小至低于液态水的密度。水的这种性质对水生动物的生存有重要意义。
范德华力和氢键:
| 范德华力 | 氢键 | |
| 概念 | 把分子聚集在一起的作用力 | 分子中与氢原子形成共价键的非金属元素原子如果吸引电子的能力很强,原子半径很小,则使氢原子几乎成为“裸露”的质子,带部分正电荷,这样的分子之间氢核与带部分负电荷的非金属元素原子相互吸引,这种静电作用就是氢键 |
| 存在范围 | 分子之间 | 某些含强极性键的氢化物分子间(如 HF、H2O、NH3)等 |
| 强弱比较 | 比化学键弱得多 | 比化学键弱,但比范德华力强 |
| 影响因素 | 组成和结构相似的由分子组成的物质,相对分子质量越大,范德华力越大 | 形成氢键的除H外的非金属元素原子吸引电子的能力越强,半径越小,则氢键越强 |
| 对物质性质的影响 | 影响物质的熔沸点、溶解度等物理性质。一般来说,组成和结构相似的由分子组成的物质,随相对分子质量的增大,物质的熔沸点升高,如熔沸点: 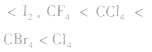 |
分子间氢键的存在,使物质的熔沸点升高,在水中的溶解度增大,如熔沸点:H2O 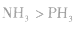 |
发现相似题
与“下列物质性质的变化规律与分子间作用力有关的是[ ]A.HF、HCl...”考查相似的试题有:
- 硫酸铜晶体溶解后溶液呈天蓝色,再滴加氨水,首先生成沉淀,继续滴加氨水,沉淀溶解,得到深蓝色透明溶液,再加入无水乙醇,...
- 下列物质性质变化规律与化学键无关的是( )①HF、HCl、HBr、HI的热稳定性依次减弱 ②NH3易液化③F2、C12、Br2、I2的熔、沸点逐...
- 下列过程中化学键未被破坏的是[ ]A.干冰升华B.溴与H2生成HBrC.SO2气体溶于水D.NaCl固体溶于水
- 下表中列出了一定压强和温度下每立方厘米活性炭所能吸附的常见气体的体积,分析表中数据与气体的组成、性质的关系,你认为下...
- 物质在下列变化过程中克服的是(填序号):①分子间作用力②共价键③离子键(1)冰融化_________;(2)液溴挥发________;(3)...
- 共价键、离子键和分子间作用力是物质间的不同作用力,下述物质中只含上述一种作用力的是( )A.干冰B.氯化钠C.氢氧化钠D.碘
- 氧是底壳中含量最多的元素。(1)氧元素基态原子核外未成对电子数为______个 。(2)H2O分子内的O-H键、分子间的范德华力和氢...
- 下列说法正确的是[ ]A.有些物质是由原子直接构成,如水晶、金刚石等;有些物质是由分子直接构成,如干冰、明矾等;有些物质...
- [化学--物质结构与性质]四种常见元素:A、B、C、D为周期表前四周期元素,原子序数依次递增,它们的性质或结构信息如下表.试...
- 共价键、离子键和范德华力都是微粒之间的不同作用力,下列含有上述两种结合力的是[ ]①Na2O2②SiO2③石墨 ④金刚石 ⑤NaCl ⑥白磷A...